Gabriel Salerni, MD,a Cristina Carrera, MD,a,b Louise Lovatto, MD,a Rosa M. Mart_ı-Laborda, MD,a,c Guillermina Isern,e Josep Palou, MD,a,d Ll_ucia Alos, MD,d Susana Puig, MD, PhD,a,b and Josep Malvehy, MD, PhDa,b
Barcelona and Lleida, Spain; and Rosario, Argentina
Актуальность исследования
Сочетанное применение тотального фотографирования тела и цифровой дерматоскопии, называемое «двухступенчатым методом цифрового наблюдения», позволяло выявлять раннюю меланому в результате отслеживания дерматоскопических и макроскопических изменений на каталог косметологических аппаратов б/у программы наблюдения.
Цель
В ходе 10-летнего мониторинга пациентов с высоким риском меланомы мы стремились оценить дерматоскопические признаки и динамические изменения, приводящие к иссечению меланоцитарных новообразований.
Методы
Мы анализировали 1152 новообразования, иссеченные во время наблюдения 618 пациентов с высоким риском меланомы с 1999 по 2008 г.
Результаты
В общей сложности 779 иссеченных новообразований были ранее зафиксированы: 728 удалены из-за дерматоскопических изменений, отмеченных в течение периода наблюдения, и 51 новообразование было иссечено, даже несмотря на то, что значительных изменений не наблюдалось.
Оставшиеся 373 иссеченные новообразования были или новыми, или неотмеченными в ходе предшествующего обследования методом тотального фотографирования тела. В общей сложности было выявлено 98 меланом, 60 — среди наблюдаемых новообразований и 38 — среди новых.
Наиболее частые дерматоскопические изменения характеризовались асимметричным увеличением почти в 60 % случаев (n=418), очаговыми изменениями структуры в 197 (27 %) и пигментации в 122 (17 %) случаях, последние два признака встречались чаще у меланом, чем у невусов (в обоих случаях P < 0,001).
Существенных изменений между дерматоскопическими и гистопатологическими признаками меланом в каждой группе выявлено не было, значительная часть меланом была неверно классифицирована как доброкачественные в обеих группах (26,3 % и 38,3 % соответственно).
Ограничения
Дерматоскопический паттерн стабильных новообразований и гистопатология неудаленных новообразований в исследование не включались.
Выводы
Наиболее частыми дерматоскопическими признаками, ассоциированными с меланомой, были очаговые изменения в пигментации или структуре. Меланомы, выявленные за счет дерматоскопических изменений, были поразительно схожи с теми, которые выявлялись методом тотального фотографирования тела. Почти 40 % меланом, выявленных у лиц с высоким риском, — новообразования, которые не находились под дерматоскопическим наблюдением (J Am Acad Dermatol 2012;67:836-45).
Краткое резюме
Двухступенчатый метод цифрового контроля позволяет не только отслеживать макроскопические изменения и появление новых новообразований, не отмеченных ранее, но также определять дерматоскопические изменения с течением времени.
Меланомы, выявленные вследствие дерматоскопических изменений, удивительно схожи с диагностированными методом тотального фотографирования тела по гистологическим и дерматоскопическим признакам. Все атипичные невусы, показывающие явные изменения во времени, должны иссекаться, чтобы не пропустить меланому.
КЛЮЧЕВЫЕ СЛОВА: синдром атипичного невуса; дерматоскопия; диспластический невус; наблюдение; техники визуализации; злокачественная меланома; результат.
Список сокращений
DFU: цифровой контроль
DM: дерматоскопическое наблюдение
MM: злокачественная меланома
Not DM: не наблюдавшееся
TBP: тотальное фотографирование тела
Исследования проводились
Melanoma Unit, Dermatology Department, a and Pathology Department,d Hospital Cl_ınic of Barcelona, IDIBAPS; CIBER de Enfermedades Raras, Instituto de Salud Carlos III, Barcelonab; Dermatology, Medicine Department, Hospital Arnau de Vilanova, Universitat de Lleidac; and Facultad de Ciencias Econ_omicas y Estad_ısticas, Universidad Nacional de Rosario, Argentina.
Исследования в Melanoma Unit, Hospital Clınic of Barcelona частично финансировалось грантами 03/0019, 05/0302, 06/0265, и 09/1393 от Фонда Fondo de Investigaciones Sanitarias, Spain; CIBER de Enfermedades Raras of the Instituto de Salud Carlos III, Spain; AGAUR 2009 SGR 1337 of the Catalan Government, Spain; by the European Commission under the Sixth Framework Programme, Contract No. LSHCCT-2006-018702(GenoMEL); и National Cancer Institute of the USNational Institutes of Health (CA83115).
Конфликт интересов
Не сообщалось.
Принято к публикации
20 января 2012.
Запросы на повторную публикацию
Susana Puig, MD,
PhD, Melanoma Unit, Dermatology Department, Hospital Clinic Barcelona,
Villarroel 170, 08036 Barcelona, Spain. E-mail: susipuig@gmail.com.
Опубликовано онлайн 23 апреля 2012.
0190-9622/$36.00_ 2012 by the American Academy of Dermatology, Inc. doi:10.1016/j.jaad.2012.01.028
Введение
Раннее выявление и хирургическое иссечение являются наиболее эффективными способами улучшения прогноза у пациентов с первичной злокачественной меланомой (ММ)1. Отличить злокачественную меланому от доброкачественного новообразования врачу часто довольно трудно. Кроме того, наложение клинических признаков может привести к тому, что злокачественная меланома будет пропущена, а удалению подвергнется чрезмерное количество доброкачественных новообразований2.
Дерматоскопия зарекомендовала себя как метод, повышающий точность диагностики ранней меланомы3-5. Тем не менее злокачественная меланома может быть не только клинически, но и дерматоскопически не отличимой от меланоцитарных невусов, особенно на ранних стадиях, когда специфический критерий злокачественности может и не присутствовать6,7.
Исходя из того, что доброкачественным новообразованиям, как правило, не свойственны изменения, а злокачественная меланома значительно меняется со временем, цифровое наблюдение (DFU) атипичных меланоцитарных новообразований, которые не вызывают подозрения на меланому, было предложено в качестве метода диагностики злокачественной меланомы, у которой вначале может быть недостаточно дерматоскопических признаков8.
Такой подход доказал эффективность в выявлении ранней меланомы без увеличения количества неоправданных удалений9-11. Была показана важность применения метода тотального фотографирования тела (TBP) в выявлении изменений формы, цвета или структуры любого новообразования и для идентификации новых невусов с использованием первичных и последующих снимков12-16.
Совместное использование TBP и цифровой дерматоскопии, так называемого двухступенчатого метода цифрового наблюдения, было разработано в нашем центре для контроля над пациентами с высоким риском злокачественной меланомы17. Метод был предложен как более чувствительный при скрининге злокачественной меланомы, позволяющий не только определять дерматоскопические изменения, происходящие с течением времени, но также выявлять макроскопические изменения и появление новообразований, ранее не зафиксированных для контроля18.
В настоящем исследовании в ходе 10-летнего наблюдения более 600 лиц с высоким риском меланомы при помощи двухступенчатого метода DFU, мы анализировали дерматоскопические признаки и динамические изменения, являющиеся показаниями к иссечению меланоцитарных новообразований. Двойная стратегия двухступенчатого метода DFU позволила нам сравнивать удаленные новообразования, которые были под дерматоскопическим наблюдением ранее (DM), с теми иссеченными новообразованиями, которые не наблюдались.
Методы
Популяция исследования
В программу наблюдения в нашем центре меланомы академической больницы Hospital Clinic of Barcelona методом TBP и цифровой дерматоскопии входили в общей сложности 618 человек в период с января 1999 по декабрь 2008 года18.
Характеристика популяции, включенной в исследование, детализирована у Salerni и соавторов18, вкратце группа представляла собой 618 пациентов со средним возрастом на дату вступления в программу 37 лет (среднее стандартное отклонение SD ±13,3 лет); 45,5 из них мужчины.
В соответствии с критерием включения в программу большинство пациентов (n=556) имели синдром атипичного невуса (определяемого как > 100 невусов и/или > 10 атипичных невусов на основании дерматоскопического и гистопатологического анализа); 227 имели личный анамнез меланомы, в том числе 73 — историю множественных первичных меланом до вступления в программу; 8 пациентов с гигантским врожденным невусом и 3 пациента, страдающие пигментной ксеродермой.
Почти треть пациентов (n=178) также имели меланому в семейном анамнезе. Пациенты наблюдались в течение 96 месяцев (медианное значение) (диапазон 13–120 месяцев). Первичные и контрольные снимки создавали при помощи стандартизированной цифровой системы (MoleMax, Derma Instruments, Vienna, Austria) — цифрового DM-устройства с цифровой видеокамерой и программным обеспечением, предназначенным для фиксации и сравнения макроскопических снимков при TBP, и дерматоскопических снимков.
Обследование производилось двухступенчатым методом цифрового наблюдения DFU, описанным выше17,18. Пациентам назначали контрольный осмотр через 3, 6 или 12 месяцев, согласно рекомендациям специалиста, проводившего оценку, и в зависимости от степени риска у конкретного пациента.
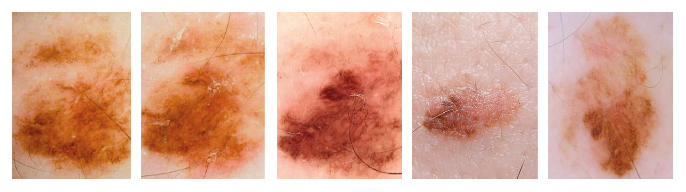
Рисунок 1.
Злокачественная меланома in situ, возникшая из врожденного невуса,
удаленного со спины 51-летнего мужчины, имевшего синдром атипичного
невуса и меланому до вступления в программу.
Новообразование
наблюдали в течение 42 месяцев на трех визитах (от A до С) до удаления в
связи с очаговыми изменениями структуры и пигментации. Клинические (D) и
дерматоскопические снимки высокого разрешения
(Е) во время иссечения. Общее количество баллов: 5,2.
Критерий включения
Изображения меланоцитарных новообразований с атипичными клиническими или дерматоскопическими признаками хранились в цифровой системе. Новообразования с ярко выраженными дерматоскопическими признаками меланомы (согласно описанию анализа паттерна19, правилу ABCD20 и 7-точечному правилу21) исключались из программы без дальнейшего наблюдения. Новообразования с выраженными дерматоскопическими признаками, свидетельствовавшими о доброкачественности невусов, не рассматривались18. Новообразования, иссеченные сразу после первого обследования, также исключались из дальнейшего исследования и далее не контролировались. Новообразования, направленные на иссечение и гистопатологическое исследование Согласно Salerni и соавторам18 изменениями, являющимися показаниями к иссечению, во время DFU являлись следующие:
1) асимметричное увеличение;
2) изменение дерматоскопических структур (расширение или уменьшение пигментной сети изменение распределения или количества пятен, глобул, изменение формы, модификация депигментированных участков или участков регрессии, появление рубцеподобных участков, бело-голубая вуаль, линии и/или атипичные сосуды);
3) увеличение количества цветов, за исключением легкого затемнения или осветления пигментации по всей площади новообразования;
4) появление участков регрессии;
5) очаговые пигментные изменения.
Все вновь появившиеся новообразования, исследованные в ходе программы наблюдения и проявлявшие атипичные дерматоскопические признаки, но не соответствовавшие критериям отнесения к меланоме, регистрировались и включались в программу или иссекались в зависимости от степени персонального риска для конкретного пациента и мнения эксперта. Все новообразования, удовлетворявшие критериям отнесения к меланоме в достаточной мере, удалялись.
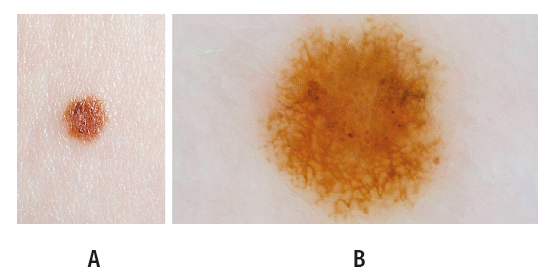
Рисунок 2. Меланома in situ, расположенная на левом бедре 32-летней женщины с синдромом атипичного невуса, с личной и семейной историей меланомы, носителя мутации гена CDKN2A. Новообразование было выявлено через 91 месяц после вступления пациентки в программу. Клинический (А) и дерматоскопический (В) снимки во время удаления. Общее количество баллов: 2,6
Гистопатология
Все иссеченные новообразования разделялись на секции и подвергались анализу в отделении патологии Центра меланомы согласно протоколу, предполагающему, что все меланоцитарные новообразования, иссеченные для выявления меланомы, должны анализироваться с соблюдением следующих правил:
1) на исследование должно поступать новообразование полностью;
2) блоки толщиной 3–4 мм должны нарезаться под правым углом по длине;
3) из каждого среза, представляющие разные участки, должны быть выделены и окрашены гематоксилин-эозином как минимум 2–3 кусочка;
4) для меланом и всех атипичных меланоцитарных новообразований, вызывающих подозрения у двух дерматологов (L. A. and J. P.), проводится иммуногистохимическое исследование (Melan A, HMB 45 и Ki67).
Гистологические критерии атипичности были представлены на основании Консенсуса национальных институтов здравоохранения США (NIH) (1992).
Новообразования, иссеченные во время исследования
Среди 11 396 новообразований, находившихся под наблюдением, 1 152 были иссечены у 407 пациентов, среднее значение составляло 2,83 новообразования на пациента (среднее стандартное отклонение ±2,39) за 10 лет программы (общий показатель иссечения 1,86 на пациента у 618 пациентов).
В общей сложности 598 (51,9 %) новообразований были удалены у женщин и 554 (48,1 %) у мужчин, медианное значение возраста таких пациентов 37 лет (среднее 39,4 SD ±13,4 лет) (детализировано у Salerni и соавторов)18. Удаленные новообразования располагались в следующих зонах: 496 (43,1 %) на спине, 328 (28,5 %) в передней области торса, 195 (16,9 %) на нижних конечностях, 78 (6,7 %) на верхних конечностях, 38 (3,3 %) на голове и шее, 16 (1,4 %) в области стоп, и одно новообразование (0,1 %) — на слизистой половых органов.
Гистопатологический диагноз иссеченных во время программы наблюдения новообразований показал: 1016 невусов (88,19 %), 98 меланом (8,5 %), 16 случаев себорейного кератоза (1,38 %), 9 — актинического кератоза (0,78 %), 7 — актинического лентиго (0,6%), 5 дерматофибром (0,43 %), и одну базальноклеточную карциному (0,1 %). Из 98 меланом, 53 (54,08 %) были меланомами in situ, и среди 45 инвазивных меланом медианное значение степени инвазии по Бреслоу составляло 0,50 мм (среднее 0,54 мм), ни одна из них не была изъязвленной.
По гистологическому подтипу почти 90 % (n = 88) были поверхностно распространяющимися, 8,16 % (n = 8) представляли собой злокачественное лентиго и 2,04 % (n = 2) относились к акрально-лентигинозному типу. Биопсия сигнального лимфоузла не требовалась ни в одном случае за время программы наблюдения. Среди невусов 492 (48,4 %) проявляли некоторую степень гистологической атипии: 190 (18,7 %) легкую, 241 (23,7 %) умеренную и 61 (6 %) выраженную18.
Таблица 1. Сравнительный анализ новообразований с данными предшествующих осмотров
| Новообразования | ||||
| Not DM | DM | Total | P | |
| Пол (%) | ||||
| Мужчины | 176 (47,18) | 378 (48,52) | 0,67 | |
| Женщины | 197 (52,82) | 401 (51,48) | ||
| Средний возраст в момент иссечения, лет (стандартное отклонение SD), y | 39,24 (613,08) | 39,99 (614,27) | 0,387 | |
| Время от момента включения в программу до иссечения (стандартное отклонение SD SD), mo | 41,32 (629,58) | 36,14 (625,9) | 0,004 | |
| Гистологический диагноз (%) | ||||
| Невус | 311 (83,3) | 705 (90,5) | 1016 | 0,096 |
| Меланома | 38 (10,19) | 60 (7,7) | 98 | |
| Себорейный кератоз | 9 (2,41) | 7 (0,9) | 16 | NA |
| Актинический кератоз | 7 (1,88) | 2 (0,26) | 9 | NA |
| Актиническое лентиго | 4 (1,07) | 3 (0,39) | 7 | NA |
| Дерматофиброма | 4 (1,07) | 1 (0,13) | 5 | NA |
| Базальноклеточная карцинома | 0 | 1 (0,13) | 1 | NA |
| Локализация | ||||
| Спина | 143 (38,34) | 353 (45,31) | 496 | |
| Передняя часть торса | 95 (25,47) | 233 (29,91) | 328 | |
| Верхние конечности | 31 (8,31) | 47 (6,03) | 78 | |
| Нижние конечности | 73 (19,57) | 122 (15,66) | 195 | |
| Голова и шея | 27 (7,24) | 11 (1,41) | 38 | |
| Ступни | 3 (0,80) | 13 (1,67) | 16 | |
| Слизистые | 1 (0,27) | 0 | 1 | |
| Регрессия (%) | 80 (21,4) | 239 (30,7) | 319 | <0,001 |
| Воспалительная реакция (%) | 35 (9,38) | 58 (7,45) | 93 | 0,259 |
| Гистологический фиброз (%) | 34 (9,12) | 72 (9,24) | 106 | 0,944 |
| Цитологическая атипия невуса (%) | ||||
| Любой степени | 121 (38,9) | 371 (52,62) | 492 | <0,001 |
| Легкая | 44 (14,14) | 146 (20,7) | 190 | 0,003 |
| Умеренная | 60 (19,29) | 181 (25,67) | 241 | 0,005 |
| Выраженная | 17 (5,46) | 44 (6,24) | 61 | 0,485 |
DM-дерматоскопическое наблюдение;
NA — не доступно;
not DM — не наблюдаемое, не находящееся под дерматоскопическим наблюдением
Статистический анализ
Для оценки различий в новообразованиях под наблюдением и новых невусов, или тех, которые ранее присутствовали, но не наблюдались, проводился бивариантный анализ; тест Xи-квадрат применялся для оценки качественных переменных, точный тест Фишера, исходя из размера образцов 2х2, и T-критерий Стьюдента использовался для сравнения средних показателей количественных переменных. Разница считалась статистически значимой, если P был ниже 0,05. Анализ методом многофакторной логистической регрессии использовался для получения отношения шансов относительно типа изменений в невусах и меланомах в течение программы наблюдения.
Результаты
Новообразования под цифровым наблюдением против новых или ранее не наблюдавшихся новообразований
Из 1152 иссеченных новообразований 779 (67,6 %) соответствовали зарегистрированным и наблюдаемым по программе цифрового наблюдения DM (Рис. 1), а оставшиеся 373 (32,4 %) были выявлены в ходе последующих визитов (Рис. 2) и являлись новыми или не нуждавшимися в фиксации и цифровом наблюдении.
В группе наблюдаемых новообразований DM решение об иссечении основывалось главным образом на микроскопических изменениях, выявленных в ходе цифрового наблюдения, в другой группе к удалению приводил критерий подозрения на меланому. Данные сравнительного анализа приведены в Таблице 1.
Наблюдаемые новообразования иссекались в среднем в течение 41,32 месяцев с момента включения пациента в исследование (Рис. 3), тогда как не наблюдавшиеся ранее иссекались в среднем че- рез 36,14 месяцев (P = 0,004). Согласно гистологическому диагнозу, не было обнаружено статистически значимых различий в количестве невусов и меланом, выявленных как новые, при сравнении с более ранними дерматоскопическими данными (P = 0,096).
Гистологическая регрессия присутствовала в 30,7 % (n = 239) наблюдавшихся новообразований и только в 21,4 % (n = 80) не наблюдавшихся (P < 0,001). Различий относительно присутствия воспалительной реакции или фиброза в гистологическом анализе не наблюдалось.
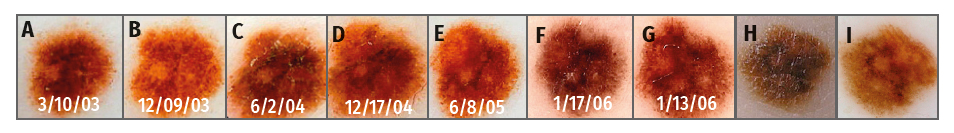
Рисунок 3.
Поверхностно распространяющаяся злокачественная меланома, степень
инвазии по Кларку 0,5 мм, возникшая из меланоцитарного невуса у
33-летнего мужчины с синдромом атипичного невуса и личной
и семейной
историей меланомы. Общая дерматоскопическая оценка во время иссечения:
4,6. Новообразование наблюдалось в течении 40 месяцев и 7 осмотрами до
тех пор, пока было иссечено через 67 месяцев после начала наблюдения
пациента (A-G). Клинические (H) и дерматоскопические
(I) снимки высокого разрешения в момент иссечения
Что касается локализации, наблюдавшиеся новообразования чаще располагались на спине и передней части торса, реже на конечностях, по сравнению с не наблюдавшимися (P<0,001). Новообразования, удаленные с зон головы и шеи чаще наблюдались ранее (7,26 % против 1,41 %).
Что касается невусов, иссеченных в ходе исследования, 492 (48,42 %) проявляли некоторую степень цитологической атипии, из них 371 (52,62 %) относился к наблюдавшимся и 121 (38,9 %) к не наблюдавшимся (P<0,001). Легкая и умеренная атипия чаще встречались среди наблюдавшихся новообразований, 20,7 % против 14,14 % (P = 0,003) и 25,67 % против 19,29 % (P = 0,005) соответственно; выраженная атипия также чаще встречалась среди наблюдавшихся новообразований (6,24 % через 5,46 %), но различия не были существенными.
Сравнительный анализ дерматоскопических признаков меланом, выявленных среди не наблюдаемых (n = 38) и среди наблюдаемых (n = 60) (Таблица 2), не показал статистически значимых различий параметров асимметрии (P = 0,919), резко обрывающихся границ (P = 0,587), множества цветов (P = 0,135), дерматоскопических структур (P = 0,332).
Во всех новообразованиях присутствовал светло-коричневый цвет, и у большого количества также темно-коричневый цвет. Не наблюдалось различий в распределении других цветов (черного, серо-голубого, розово-красного, белого) между двумя группами.
Наличие бесструктурных участков, занимавших более 10 % поверхности новообразования, и более двух пятен или глобул чаще встречалось среди не наблюдавшихся меланом, хотя различия не были значимыми. Также не было выявлено существенных различий между двумя группами ни относительно общего количества баллов (P = 0,302), ни в отношении присутствия дополнительных критериев (псевдоподы, васкуляризация и регрессия) или различных дерматоскопических рисунков.
Согласно гистопатологическому исследованию, не было статистически значимых различий между наблюдавшимися и не наблюдавшимися новообразованиями в отношении подтипа меланомы, количества меланом in situ, степени инвазии по Кларку, по Бреслоу, наличия изъязвлений, доли меланом, прогрессировавших из меланоцитарных невусов.
Дерматоскопические признаки, требующие иссечения
В общей сложности 779 наблюдавшихся новообразований были иссечены за время исследования. Из них 728, включая 655 невусов, 60 меланом и 13 немеланоцитарных новообразований, были иссечены из-за дерматоскопических изменений, проявившихся в ходе программы наблюдения; где 51 новообразование (50 невусов и одна дерматофиброма) было иссечено независимо от того, что значительных изменений не наблюдалось.
В последней группе решение об удалении основывалось главным образом на дерматоскопических признаках и отсутствием уверенности в природе новообразования. Значительные изменения в ходе DFU были классифицированы таким образом: асимметричное увеличение, очаговые изменения пигментации и/или структуры, регрессия и изменения цвета.
Таблица 2. Сравнительный анализ дерматоскопических признаков новых и находившихся под наблюдением меланом
| Новообразования | ||||
| Not DM | DM | Total | P | |
| Дерматоскопическое правило ABCD | ||||
| Асимметрия (%) | 0,919 | |||
| Симметричное | 3 (7,89) | 6 (10) | 9 | |
| 1 Ось | 9 (23,68) | 15 (25) | 24 | |
| 2 Оси | 26 (68,42) | 39 (65) | 65 | |
| Прерывающиеся границы | 0,587 | |||
| 0 | 10 | 26 | 36 | |
| 1 of 8 | 2 | 3 | 5 | |
| 2 of 8 | 6 | 7 | 13 | |
| 3 of 8 | 4 | 4 | 8 | |
| 4 of 8 | 11 | 9 | 20 | |
| 5 of 8 | 2 | 6 | 8 | |
| 6 of 8 | 2 | 4 | 6 | |
| 7 of 8 | 0 | 0 | 0 | |
| 8 of 8 | 1 | 1 | 2 | |
| Количество цветов (%) | ||||
| 1 | 1 (2,63) | 0 | 1 | NA |
| 2 | 5 (13,16) | 12 (20) | 17 | NA |
| 3 | 14 (36,84) | 29 (48,35) | 43 | |
| 4 | 16 (42,11) | 14 (23,33) | 30 | |
| 5 | 1 (2,63) | 4 (6,67) | 5 | NA |
| 6 | 1 (2,63) | 1 (1,67) | 2 | NA |
| Цвета (%) | ||||
| Светло-коричневый | 38 (100) | 60 (100) | 98 | NA |
| Темно-коричневый | 32 (84,21) | 59 (98,33) | 91 | NA |
| Черный | 21 (55,26) | 23 (38,33) | 44 | 0,101 |
| Серо-голубой | 19 (50) | 27 (45) | 46 | 0,629 |
| Белый | 6 (15,78) | 8 (13,33) | 14 | 0,735 |
| Розово-красный | 10 (26,32) | 15 (25) | 25 | 0,884 |
| Количество дерматоскопических структур (%) | 0,332 | |||
| Дерматоскопическое правило ABCD | ||||
| Прерывающиеся границы | 0,587 | |||
| 1 | 5 (13,15) | 14 (23,33) | 19 | |
| 2 | 18 (47,36) | 30 (50) | 48 | |
| 3 | 15 (39,47) | 14 (23,33) | 29 | |
| 4 | 0 | 1 (1,67) | 1 | |
| 5 | 0 | 1 (1,67) | 1 | |
| Дерматоскопические структуры (%) | ||||
| Пигментная сеть | 35 (92,11) | 60 (100) | 95 | NA |
| Ветвистые линии | 3 (7,89) | 3 (5) | 6 | NA |
| Бесструктурные участки | 17 (44,74) | 19 (31,67) | 36 | 0,191 |
| >2 единиц | 17 (44,74) | 17 (28,33) | 34 | 0,096 |
| ≥ 2 Глобул | 16 (42,11) | 23 (38,33) | 39 | 0,71 |
| Классификация по общему количеству баллов TDS (%) | 0,469 | |||
| Доброкачественное | 10 (26,32) | 23 (38,33) | 33 | |
| Злокачественное | 20 (52,63) | 26 (43,33) | 46 | |
| Подозрительное | 8 (21,05) | 11 (18,33) | 19 | |
| Дополнительный критерий (%) | ||||
| Псевдоподы | 2 (5) | 1 (1,67) | 4 | NA |
| Васкуляризация | 4 (10,53) | 6 (10) | 10 | NA |
| Регрессия | 15 (39,47) | 25 (41,67) | 40 | 0,83 |
| Дерматоскопический паттерн dermatoscopy pattern (%) | 0,087 | |||
| Сетчатый | 18 (47,37) | 41 (68,33) | 59 | |
| Мультикомпонентный | 16 (42,11) | 17 (28,33) | 33 | |
| Параллельный | 1 (2,63) | 1 (1,67) | 2 | |
| Неспецифический | 3 (7,89) | 1 (1,67) | 4 | |
| Гистологический подтип меланомы (%) | 0,255 | |||
| Поверхностно распространяющаяся | 32 (84,21) | 56 (93,33) | 87 | |
| Злокачественное лентиго | 5 (13,16) | 3 (5,00) | 8 | |
| Акральный лентигиноз | 1 (2,63) | 1 (1,67) | 2 | |
| Узловая | 0 | 0 | 0 | |
| Степень инвазии по Кларку (%) | 0,799 | |||
| I-MM in situ | 19 (50) | 34 (56,67) | 53 | |
| II | 9 (23,68) | 13 (21,67) | 22 | |
| III | 10 (26,32) | 13 (21,67) | 23 | |
| Изъязвления (%) | 0 | 0 | 0 | |
| MM, развившаяся из невуса (%) | 11 (28,95) | 16 (26,67) | 27 | 0,806 |
| Степень инвазии по Бреслоу (среднее значение), мм | 0,573 (0,25-0,9) | 0,532 (0,3-1) | 0,377 |
Также выделялись новообразования, иссеченные в результате симметричного увеличения, при отсутствии других значительных изменений. Наиболее частым морфологическим изменением было асимметричное увеличение почти в 60 % в (n = 418) из 728 наблюдавшихся новообразований. Очаговые изменения структуры или пигментации наблюдались примерно в 27 % (n = 197) и 17 % (n=122) соответственно. Около 25 % (n=178) иссеченных новообразований показывали изменение окраски и 23 % (n=167) регрессию.
В общей сложности 52 новообразования (49 невусов, одна меланома, один случай пигментного актинического кератоза и один случай солнечного лентиго) были иссечены за счет симметричного увеличения и отсутствия других существенных изменений. Очаговые изменения пигментации и структуры чаще наблюдались среди меланом, чем среди невусов (odds ratio 2,988 и 5,47 соответственно, в обоих случаях P <0,0001).
Асимметричное увеличение, регрессия и изменения окраски чаще наблюдались у меланом, чем у невусов, но различия не были статистически значимыми.
Таблица 4. Тип дерматоскопических изменений, выявленных у меланом и невусов во время дерматоскопического наблюдения
| Тип изменения | Меланомы, N = 60 N (%) | Невусы, N = 655 N (%) | OR | 95 % CI | P |
| Асимметричное увеличение | 39 (65) | 375 (57,27) | 1,387 | 0,798-2,41 | 0,245 |
| Очаговые изменения пигментации | 21 (35) | 100 (15,27) | 2,988 | 1,687-5,293 | <0,0001 |
| Очаговые изменения структуры | 38 (63,33) | 157 (23,97) | 5,47 | 3,146-9,543 | <0,0001 |
| Регрессия | 18 (30) | 143 (21,83) | 1,534 | 0,857-2,747 | 0,147 |
| Изменения цвета | 20 (33,33) | 152 (23,21) | 1,655 | 0,939-2,916 | 0,079 |
CI, Степень достоверности; OR, отношение шансов.
По крайней мере теоретически, по результатам гистопатологического исследования мы ожидаем диагностировать меланомы, возникшие de novo (выявленные как новые или в результате мониторинга макроскопических изменений методом картирования тела), и меланомы, выросшие из меланоцитарных невусов, которые показывают изменения во времени согласно наблюдениям. Интересно, что мы не нашли разницы между количеством меланом de novo и развившихся из меланоцитарных невусов в двух группах.
Это неожиданное наблюдение можно объяснить тем, что медленно растущие меланомы, без подлежащего невуса, очень медленно развивавшиеся и имевшие обычный вид, встречались в каждой группе. Динамические изменения меланоцитарных новообразований нередко выявляются при цифровом наблюдении. Разделение изменений, позволяющих распознать раннюю меланому, и изменений, характерных для доброкачественных меланоцитарных новообразований, может быть затруднено27.
За последние годы накопились доказательства в пользу цифровой дерматоскопии меланоцитарных новообразований относительно определения микроскопических изменений, которые могут предупредить диагноз меланомы23,31.
В настоящее время достаточно доказательств тому, что последовательная цифровая дерматоскопическая съемка должна по возможности применяться у популяции с повышенным риском для выявления ранних меланом при отсутствии других дерматоскопических признаков6,7,17,18,33-35.
Как ожидалось, все типы изменений, которые считались значительными во время исследования, были более распространены при меланоме, чем при обычном невусе. Мы увидели, что очаговые изменения пигментации и структуры были значительно более частыми при меланоме, чем при невусах (отношение рисков 2,988 и 5,47 соответственно), но не было значительных различий относительно асимметричного увеличения, регрессии или изменения пигментации.
В нашем исследовании 53 новообразования были иссечены только из-за асимметричного увеличения, изменения, которое не считается значительным. В их числе мы обнаружили одну меланому с инвазией по Бреслоу 0,5 мм, изначально классифицированную как доброкачественное новообразование, согласно правилу ABCD. Kittler и соавторы обнаружили, что одна меланома, изначально диагностированная как атипичный невус, показывала асимметричный рост без структурных изменений.
Наши открытия поддерживают их рекомендацию иссекать как меланому все атипичные невусы, показывающие устойчивые изменения во времени. Эта работа посвящена всем нашим пациентам и их семьям, которые всегда сотрудничали с нами и являлись целью нашей работы.
Мы благодарны нашим коллегам дерматологам, друзьям, среди которых Isabel Kolm, Allison Bell Smythe, Renata Lorenzato, Florencia Cabrini, Myrna Hanke, Joane Portella, мед- сестрам, которые ежедневно работают, и чьи усилия не всегда отмечены в научных статьях. Мы также благодарим Helena Kruyer за помощь в подготовке текста.
Список литературы
1. Kopf AW, Welkovich B, Frankel RE, Stoppelmann EJ, Bart RS, Rogers GS, et al. Thickness of malignant melanoma: global analysis of related factors. J Dermatol Surg Oncol 1987;13: 345-20.
2. Lindel€of B, Hedblad MA. Accuracy in the clinical diagnosis and pattern of malignant melanoma at a dermatological clinic. J Dermatol 1994;21:461-4.
3. Bafounta ML, Beauchet A, Aegerter P, Saiag P. Is dermoscopy (epiluminescence microscopy) useful for the diagnosis of melanoma? Results of a meta-analysis using techniques adapted to the evaluation of diagnostic tests. Arch Dermatol 2001;137:1343-50.
4. Kittler H, Pehamberger H, Wolff K, Binder M. Diagnostic accuracy of dermoscopy. Lancet Oncol 2002;3:159-65.
5. Vestergaard ME, Macaskill P, Holt PE, Menzies SW. Dermoscopy compared with naked eye examination for the diagnosis of primary melanoma: a meta-analysis of studies performed in a clinical setting. Br J Dermatol 2008;159:669-76.
6. Kittler H, Guitera P, Riedl E, Avramidis M, Teban L, Fiebiger M, et al. Identification of clinically featureless incipient melanoma using sequential dermoscopy imaging. Arch Dermatol 2006; 142:1113-9.
7. Puig S, Argenziano G, Zalaudek I, Ferrara G, Palou J, Massi D, et al. Melanomas that failed dermoscopic detection: a combined clinicodermoscopic approach for not missing melanoma. Dermatol Surg 2007;33:1262-73.
8. Stolz W, Schiffner R, Pillet L, Vogt T, Harms H, Schindewolf T, et al. Improvement of monitoring of melanocytic skin lesions with the use of a computerized acquisition and surveillance unit with a skin surface microscopic television camera. J Am Acad Dermatol 1996;35:202-7.
9. Carli P, De Giorgi V, Crocetti E, Mannone F, Massi D, Chiarugi A, et al. Improvement of malignant/benign ratio in excised melanocytic lesions in the ‘dermoscopy era’: a retrospective study 1997-2001. Br J Dermatol 2004;150:687-92.
10. Carli P, de Giorgi V, Chiarugi A, Nardini P, Weinstock MA, Crocetti E, et al. Addition of dermoscopy to conventional naked-eye examination in melanoma screening: a randomized study. J Am Acad Dermatol 2004;50:683-9.
11. Kittler H, Binder M. Follow-up of melanocytic skin lesions with digital dermoscopy: risks and benefits. Arch Dermatol 2002; 138:1379.
12. Halpern AC. Total body skin imaging as an aid to melanoma detection. Semin Cutan Med Surg 2003;22:2-8.
13. Banky JP, Kelly JW, English DR, Yeatman JM, Dowling JP. Incidence of new and changed nevi and melanomas detected using baseline images and dermoscopy in patients at high risk for melanoma. Arch Dermatol 2005;141:998-1006.
14. Wang SQ, Kopf AW, Koenig K, Polsky D, Nudel K, Bart RS. Detection of melanomas in patients followed up with total cutaneous examinations, total cutaneous photography, and dermoscopy. J Am Acad Dermatol 2004;50:15-20.
15. Goodson AG, Florell SR, Hyde M, Bowen GM, Grossman D. Comparative analysis of total body and dermatoscopic photographic monitoring of nevi in similar patient populations at risk for cutaneous melanoma. Dermatol Surg 2010;36:1087-98.
16. Risser J, Pressley Z, Veledar E, Washington C, Chen SC. The impact of total body photography on biopsy rate in patients from a pigmented lesion clinic. J Am Acad Dermatol 2007;57: 428-34.
17. Malvehy J, Puig S. Follow-up of melanocytic skin lesions with digital total-body photography and digital dermoscopy: a two-step method. Clin Dermatol 2002;20:297-304.
18. Salerni G, Carrera C, Lovatto L, Puig-Butille JA, Badenas C, Planas E, et al. Benefits of total body photography and digital dermoscopy (‘‘two-step method of digital follow-up’’) in the early diagnosis of melanoma in high-risk patients J Am Acad Dermatol doi: 10.1016/j.jaad.2011.04.008. Published online June 17, 2011
19. Pehamberger H, Steiner A, Wolff K. In vivo epiluminescence microscopy of pigmented skin lesions, I: pattern analysis of pigmented skin lesions. J Am Acad Dermatol 1987;17:571-83.
20. Stoltz W, Braun-Falco O, Bilek P, Landthaler M, Cognetta A. A color atlas of dermoscopy. Germany: Blackwell Science; 1994.
21. Argenziano G, Fabbrocini G, Carli P. Epiluminescence microscopy for the diagnosis of doubtful melanocytic skin lesions: comparison of the ABCD rule of dermatoscopy and a new 7-point checklist based on pattern analysis. Arch Dermatol 1998;134:1563-70.
22. Argenziano G, Soyer HP, Chimenti S, Talamini R, Corona R, Sera F, et al. Dermoscopy of pigmented skin lesions: results of a consensus meeting via the Internet. J Am Acad Dermatol 2003;48:679-93.
23. Schiffner R, Schiffner-Rohe J, Landthaler M, Stolz W. Long-term dermoscopic follow-up of melanocytic nevi: clinical outcome and patient compliance. Br J Dermatol 2003;149:79-86.
24. Haenssle HA, Krueger U, Vente C, Thoms KM, Bertsch HP, Zutt M, et al. Results from an observational trial: digital epiluminescence microscopy follow-up of atypical nevi increases the sensitivity and the chance of success of conventional dermoscopy in detecting melanoma. J Invest Dermatol 2006;126: 980-5.
25. Bauer J, Blum A, Strohhacker U, Garbe C. Surveillance of patients at high risk for cutaneous malignant melanoma using digital dermoscopy. Br J Dermatol 2005;152:87-92.
26. Robinson JK, Nickoloff BJ. Digital epiluminescence microscopy monitoring of high-risk patients. Arch Dermatol 2004;140: 49-56.
27. Kittler H, Pehamberger H, Wolff K, Binder M. Follow-up of melanocytic skin lesions with digital epiluminescence microscopy: patterns of modifications observed in early melanoma, atypical nevi, and common nevi. J Am Acad Dermatol 2000;43: 467-76.
28. Haenssle HA, Korpas B, Hansen-Hagge C, Buhl T, Kaune KM, Johnsen S, et al. Selection of patients for long-term surveillance with digital dermoscopy by assessment of melanoma risk factors. Arch Dermatol 2010;146:257-64.
29. Argenziano G, Mordente I, Ferrara G, Sgambato A, Annese P, Zalaudek I. Dermoscopic monitoring of melanocytic skin lesions: clinical outcome and patient compliance vary according to follow-up protocols. Br J Dermatol 2008;159: 331-6.
30. Menzies SW, Gutenev A, Avramidis M, Batrac A, McCarthy WH. Short-term digital surface microscopic monitoring of atypical or changing melanocytic lesions. Arch Dermatol 2001;137: 1583-9.
31. Fuller SR, Bowen GM, Tanner B, Florell SR, Grossman D. Digital dermoscopic monitoring of atypical nevi in patients at risk for melanoma. Dermatol Surg 2007;33:1198-206.
32. Weatherhead SC, Haniffa M, Lawrence CM. Melanomas arising from nevi and de novo melanomasedoes origin matter? Br J Dermatol 2007;156:72-6.
33. Australian Cancer Network (ACN). Clinical practice guidelines for the management of melanoma in Australia and New Zealand (2008). Available from: URL:http://www.nhmrc.gov.au/_files_nhmrc/publications/ attachments/cp111.pdf. Accessed March 30, 2012.
34. Carrera C, Palou J, Malvehy J, Segura S, Segura S, Aguilera P, et al. Early stages of melanoma on the limbs of high-risk patients: clinical, dermoscopic, reflectance confocal microscopy and histopathological characterization for improved recognition. Acta Derm Venereol 2011;91:137-46.
35. Salerni G, Lovatto L, Carrera C, Puig S, Malvehy J. Melanomas detected in a follow-up program compared with melanomas referred to a melanoma unit. Arch Dermatol 2011;147: 549-55.
Вам также могут быть интересны статьи
- Связь между различными масштабными шкалами на дерматоскопических изображениях
- Клиническая и гистологическая оценка результатов процедур RF-методом с использованием ультратонких электродов длиной 1 мм
- Использование методики интенсивного импульсного света (IPL, Intensive Pulse Light) в комплексном лечении блефаритов и синдрома «сухого глаза»
- Микроигольчатый RF – насколько важна длина игл?
- Улучшение текстуры кожи и состояния морщин при использовании RF-энергии, передаваемой через ультратонкие электроды