Juliana Hypo ́ lito SilvaI, Bianca Costa Soares de Sa ́II, Alexandre Leon Ribeiro de A ́ vilaII, Gilles Landman, IIIJoa ̃o Pedreira Duprat NetoII
IOncology School Celestino Bourroul — Hospital AC Camargo, Sa ̃o Paulo, SP, Brazil. IISkin Oncology Depart-ment — Hospital AC Camargo — Sa ̃o Paulo, SP, Brazil. IIIPathology Department — Hospital AC Camargo — Sa ̃o Paulo, SP, Brazil.
Синдром атипичного невуса — наиболее важный фенотипический фактор риска развития мела- номы кожи — злокачественной опухоли, являющейся причиной летального исхода у 80 % пациентов, страдающих раком кожи. Поскольку диагностика меланомы на ранней стадии крайне важна, выявление носителей синдрома атипичного невуса является основополагающим, так же как и выработка превентивных мер, обязательных для соблюдения такими пациентами.
КЛЮЧЕВЫЕ СЛОВА: синдром диспластического невуса, диспластический невус, меланома, ранняя диагностика, факторы риска.
Silva JH, de Sa ́ BC, Avila ALR, Landman G, Duprat Neto JP. Atypical
mole syndrome and dysplastic nevi: identification of populations at risk
for developing melanoma — review article. Clinics. 2011;66(3):493-499.
Принято
к публикации 23 ноября 2010 года; Первое рассмотрение завершено 24
ноября 2010 года; Принято к печати 24 ноября 2010 года.
E-mail: bianca.sa@terra.com.br
Tel.: 55 11 2189-5135
Copyright_2011
CLINICS — Эта статья находится в свободном доступе, распространяется в
соответствии с условиями лицензии с указанием авторства Creative Commons
Attribution License, (http://creative-
commons.org/licenses/by-nc/3.0/), допускающей неограниченное
использование, распространение, воспроизведение в любом средстве
массовой информации с указанием автора и источника.
Введение
Количество случаев меланомы кожи быстро увеличивается во всем мире1-5. Хотя меланома составляет только 4 % всех видов рака кожи, она приводит к летальному исходу в 80 % случаев4. Ранняя диагностика этого заболевания облегчает лечение и только 14 % пациентов с метастазами переживают 5-летний срок4-6, поэтому знание персональных факторов повышенного каталог косметологических аппаратов б/у меланомы и понимание важности диагностики на ранней стадии имеют большое прогностическое значение.
Факторы риска меланомы могут быть и генетическими, и внешними, связанными с воздействием окружающей среды, особенно при наличии множества меланоцитарных невусов, диспластических невусов и синдрома атипичного невуса (AMS) как основных клинических фенотипических признаков, влияющих на восприимчивость4-9.
В 1820 году Norris10 описал то, что сейчас считается семейной предрасположенностью к меланоме. В 1978 году Clark11 сообщил о повышенном распространении меланомы в семьях, у представителей которых имеются множественные меланоцитарные новообразования, представив модель меланомы, прогрессирующей из меланоцитарных невусов11,12. В то время Clark использовал термин синдром B-K невусов, составленный из первых букв фамилий пациентов11. В настоящее время используются термины AMS, синдром диспластического невуса и синдром семейной атипичной множественной меланомы (FAMMM)12.
В 1985 году Elder13 расширил теорию о невус-меланоме относительно спорадических диспластических невусов, являющихся возможными предшественниками спорадической меланомы. Несколько исследований показали, что присутствие диспластических невусов значительно увеличивает риск развития меланомы, что демонстрирует, что такие новообразования кроме того, что являются предшественниками заболевания, также представляют собой маркеры риска4,7,14-19. Тем не менее степень риска варьируется у пациентов с этим типом пигментных новообразований3,14,15,16,20.
До сих пор в литературе существуют разночтения относительно номенклатуры, клинического определения, дерматоскопических характеристик и гистопатологических, генетических и молекулярных паттернов диспластических невусов4,8.
В этом обзоре диспластических невусов и AMS мы показываем важность полного дерматоло- гического обследования для оценки и мониторинга пациентов с диспластическими невусами и AMS и предлагаем критерии контроля.
Эпидемиология
Диспластические невусы относительно распространены у основной части населения8. В отчетах описаны разные степени их преобладания от 2 % в одних до 53 % в других в зависимости от диагностических критериев (клинических или гистологических)8. Более точным показателем считается 2–8 % среди белого населения, преимущественно у молодых людей (моложе 30 и до 40 лет)18. Частота появления диспластических невусов у пациентов с историей меланомы гораздо выше: 34–59 %18.
Предполагается, что воздействие солнца, в дополнение к генетической предрасположенности, может увеличить риск появления таких невусов1,8,18. Данные относительно преобладания AMS трудно документировать отдельно за счет большого разнообразия диагностических критериев, используемых в разных исследованиях.
Основываясь на оценке, проведенной Национальными институтами здравоохранения США (National Institutes of Health (NIH)), было выяснено, что 32 000 человек были носителями AMS и семейной меланомы в США в 1985 году при 4 миллионах, страдающих спорадическим AMS3,21.
Генетика
AMS может быть спорадическим или наследственным, при этом аутосомно-доминантное наследование предполагается с различной степенью выраженности и неполной пенетрантностью22.
Однако есть отчеты относительно связей между развитием AMS и изменением хромосом 9p21 и 1p3623. Было показано, что присутствие диспластических невусов увеличивает риск меланомы у пациентов с герминальными мутациями в гене CDKN2A, основном геномном локусе восприимчивости к меланоме24,25. Этот геномный локус содержит два важных гена, вовлеченных в контроль клеточного цикла, старение и апоптоз: p16 и p14ARF.
Присутствие гена предрасположенности к развитию диспластических невусов также наблюдалось в хромосоме 7q213 у пациентов с мутацией гена p16 в четырех семьях с семейной меланомой20. Высокая распространенность соматических мутаций BRAF гена также определялась у пациентов с диспластическими невусами и первичными меланомами8. Более того, у меланоцитарных новообразований, для которых характерен быстрый рост или развитие, больший шанс мутации этого гена по сравнению с новообразованиями без истории изменений их клинических аспектов8.
Дру- гие генетические изменения, отмеченные в диспластических невусах, включают микросателлитную нестабильность, потерю гетерозиготности (LOH) и повышенную активность фермента теломеразы12. В настоящее время известно, что только 20–30 % меланом развиваются из меланоцитарного невуса, что показывает, что теория Кларка о прогрессировании может объяснить только один из путей от канцерогенеза к меланоме26.
Пациенты с диспластическими невусами могут иметь пониженную способность к восстановлению повреждений ДНК, индуцированных UV излучением8. Хотя генетические и иные факторы бесспорно вовлечены в патогенез меланоцитарной трансформации, понимание его молекулярных механизмов до сих пор недостаточное8.
Клиническая диагностика
Клинически диспластический невус, как правило, представляет собой новообразование в виде пятна 5 мм или более в диаметре, с нерегулярными и плохо очерченными границами, с различными оттенками коричневого цвета, и, возможно, красными и белыми участками 18. Он часто представляет собой папулу, окруженную пигментным пятнистым кольцом, напоминающим яичницу 18. Таким образом, имеется значительное пересечение с правилом ABCDE, используемым для клинической диагностики меланомы, а именно: А — асимметрия, В — нечеткие границы, С — различные цвета, D — диаметр > 6 мм и E — прогресcирование (случайное появление пятнистых или папульных компонентов)3,12,18 (Рисунок 1).
Диспластические невусы могут присутствовать на любых участках, включая прикрытые зоны (ягодицы, грудь), радужку, стопу и скальп головы1,3,18,27. Однако, несмотря на появление их в таких необычных местах, торс остается наиболее распространенной локализацией для развития диспластических невусов18,27. Эти новообразования обычно возникают в пубертатном периоде, но могут встречаться и у детей в предпубертатном периоде, а также у взрослых, и оставаться относительно динамичными по мере взросления, а могут впоследствии исчезать3,18,27.
Также наблюдалось, что количество диспластических невусов напрямую коррелирует с общим числом меланоцитарных невусов у человека27. Более того, с клинической точки зрения известно, что атипичный невус может возникать из схожего меланоцитарного невуса или показывать атипичные признаки сразу после своего появления27.
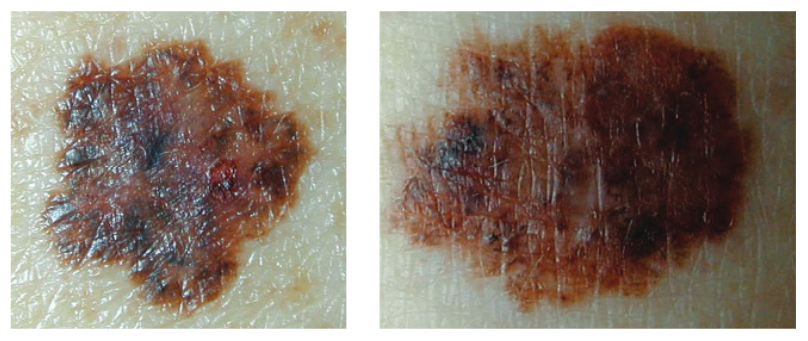
Рисунок 1. Макроскопический снимок двух меланоцитарных новообразований, характеристики которых пересекаются с правилом ABCD (асимметрия, нерегулярные границы, различные цвета, диаметр более 6 мм): слева — диспластический невус; справа – меланома кожи
Как динамические новообразования, они могут становиться более или менее атипичными в своих клинических аспектах27. Хотя большинство диспластических невусов остаются неизменными, уменьшаются со временем или изменяются, но остаются доброкачественными, наблюдение за этими невусами крайне важно. Их профилактическое иссечение нерационально8,27.
AMS уже описывался несколькими авторами и институтами, основываясь на клинических характеристиках пациентов и их личной и семейной истории меланомы, с гистопатологическим подтверждением атипичного невуса3 или без него. Согласно Newton и соавторам1, AMS можно определить по шкале, присуждая 1 балл за каждый при- знак, как видно из Таблицы 1. Пациенты с баллом равным или превышающим 3, считались носителями фенотипа AMS1 (Рисунок 2).
Таблица 1. Классификация AMS и их специфических признаков
| Классификация | 66,6 (30-87) | 71 (45-92) |
| Newton и соавторы (1993) | 1) два или более атипичных невуса; 2) более 100 невусов у пациентов в возрасте от 20 до 50 лет; 3) более 50 невусов у пациентов моложе 20 лет или старше 50 лет; 4) более одного невуса на ягодицах или ступнях; 5) невусы на передней части скальпа; 6) одно или более пигментных новообразование на радужной оболочке глаза. | 3 и более баллов характеризуют фенотип AMS |
| Классическая (1990) | 1) 100 и более меланоцитарных невусов, 2) 1 или более меланоцитарных невусов, равных или более 8 мм в максимальном 3) один или более клинически атипичных невусов | Для диагностики требуется наличие всех признаков. Необходимость подсчета общего количества невусов для классификации; низкая чувствительность |
| Консенсус Национальных институтов здравоохранения (National Institutes of Health (NIH)) 1992 | 1) случаи меланомы у одного или более родственников первой или второй линии; 2) большое количество меланоцитарных невусов, как правило, более 50, некоторые из них атипичные и часто различные по размеру; 3) меланоцитарные невусы, имеющие определенные гистологические признаки * (*определены Консенсусом) | Требуются специфические гистологические признаки, противоречив и рассматривает только пациентов с семейной историей меланомы |
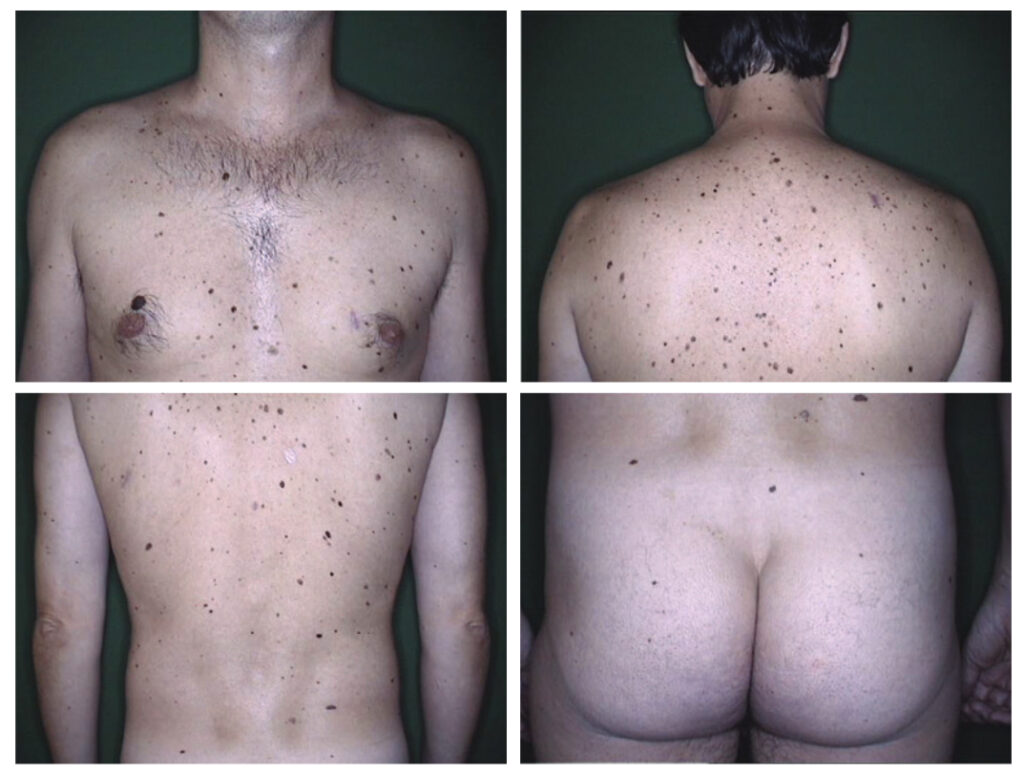
Рисунок 2. Снимок картирования тела мужчины 34 лет, 256 невусов, отобранных для контроля.
Имеются 3 критерия отнесения к AMS — более 100 невусов, присутствие более 2 клинических
диспластических невусов и невусов на ягодицах
Таблица 2. Классификации Kraemer и Rigel
| Тип | AN пациент | CM пациент | Семейный AN | Семейный СМ |
| A | + | — | — | — |
| D | + | — | + | — |
| C | + | + | — | — |
| D1 | + | + | + | — |
| + | + | — | + | |
| + | + | + | + | |
| D2 | + | +/- | +/- | > 1 family |
AN — диспластический невус
CM — меланома кожи
+ — один или более родственников с меланомой кожи
А и С: спорадический AMS
D1 Только один родственник в семье имел меланому (может быть сам пациент)
D2 Как минимум два родственника имели меланому(может включать пациента)
Родственники: бабушки, дедушки, родители, тети, дяди, сыновья, дочери
Таблица 2. Классификации Kraemer и Rigel (продолжение)
| Группа | Кол-во баллов | Риск злокачественной меланомы |
| 0 | 0 | 6% |
| I | 1 | 10% |
| II | 2 | 15% |
| III | 3+ | 50% |
*совокупный риск за 25 лет
Балл = сумма:
личной истории злокачественной меланомы = 1
семейной истории злокачественной меланомы = 2
Также были описаны другие классификации, включая так называемые классические AMS, когда у пациента более 100 невусов, как минимум одно новообразование с клиническими признаками атипичного невуса или невус 8 мм и более в диаметре3,28. Классификация, разработанная National Institutes of Health (NIH), включает только пациентов с семейной историей меланомы (Таблица 1)29.
Классификации Kraemer16 и Rigel15 показывают степень риска возникновения меланомы у пациентов с AMS, которая является наиболее зависимой от личной и семейной истории меланомы, и в некоторых случаях сообщалось об относительном риске (RR) 12693. Согласно Kraemer и соавторам16, пациентов с AMS можно классифицировать по следующим типам в зависимости от их наследственных характеристик:
- тип А – спорадический AMS;
- тип В – семейный AMS;
- тип С – спорадический AMS с личным анамнезом меланомы;
- тип D1 – семейный AMS с историей меланомы у одного из членов семьи;
- тип D2 – семейный AMS с историей меланомы у двух или более членов семьи.
Разные типы заболевания показывают разный риск развития меланомы кожи.
Rigel и соавторы15,30 классифицировали пациентов с AMS по 4 группам риска в зависимости от наличия или отсутствия личного и/или семейного анамнеза меланомы, где 1 балл добавляется при личной истории и 2 — при семейной (Таблица 2).
Сумма баллов повышает относительный риск развития меланомы следующим образом:
- группа 0: ни одного балла (RR:33-444);
- группа I: 1 балл (RR:8-127);
- группа II: 2 балла (RR: 33-444);
- группа III: 3 балла (RR: 85-1269) (Таблица 2)3,15,30.
Таким образом, присутствие диспластических невусов и AMS можно рассматривать как спектр фенотипических экспрессий, которые свойственны носителям разных рисков развития меланомы3,21.
Спектр риска варьируется от лиц со спорадическими диспластическими невусами, без личного или семейного анамнеза меланомы до абсолютно противоположных лиц из семей, 2 или более представителей которых имели меланому, формируя так называемый семейный синдром множественной атипичной меланомы (FAMMM)3,4,15,16,20,31. Кроме того, представляя группу повышенного риска развития меланомы кожи, пациенты с AMS могут иметь неоплазию в необычных местах (например, на скальпе) в более раннем возрасте, чем не являющиеся носителями синдрома1. Также у таких пациентов повышен риск множественной меланомы и некожной меланомы, например, меланомы сетчатки глаза8.
Проспективные исследования показывают, что риск меланомы у членов семьи, страдающих AMS и FAMMM, является значительным и предположительно совокупным и составляет 49 % у лиц от 10 до 50 лет и 82 % — у пациентов 72 лет32.
Гистопатология
Хотя гистопатологическое исследование считается золотым стандартом диагностики меланоцитарных опухолей, существуют ограничения гистологического различия между ранней меланомой и диспластическими невусами12. В нескольких исследованиях повторяемость в классификации атипии остается от незначительной до умеренной за счет отсутствия универсального критерия, принятого среди дерматопатологов12,18.
Основываясь на консенсусе Всемирной организации здравоохранения (ВОЗ) и NIH, гистопатологический диагноз диспластического невуса (Рисунок 3) основывается на основном критерии (обязательном) и второстепенном (должны присутствовать как минимум два)23, описанных в Таблице 3.
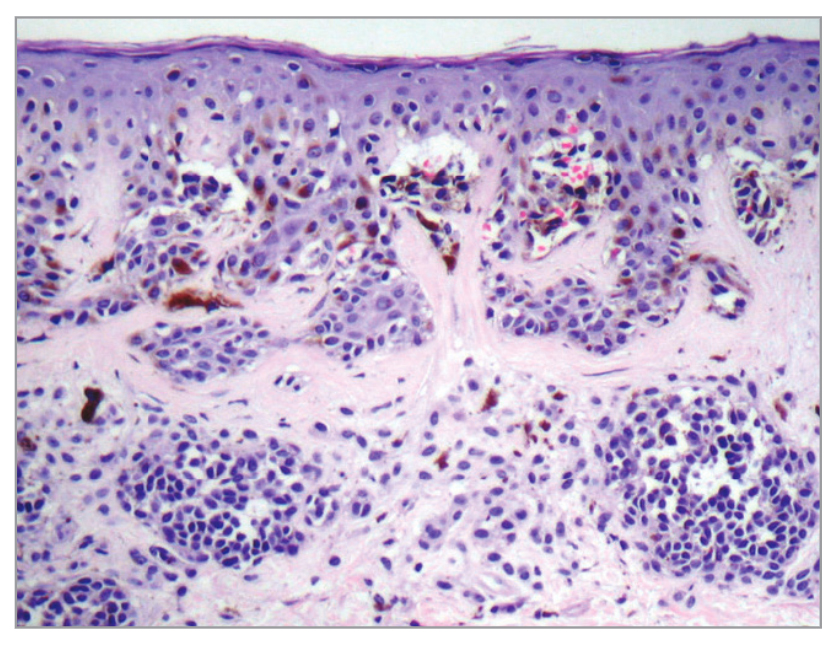
Рисунок 3. Гистопатологическое исследование атипичного невуса, имеющего очаговую меланоцитарную атипию. Соединение эпителиальных тканей и концентрический ламеллярный фиброз. Оптический макроскопический снимок с большим увеличением (40X)
Диагностика и контроль
Клиническое различие между доброкачественными и злокачественными пигментными новообразованиями в некоторых случаях является спорным. Однако, как показано в некоторых исследованиях, использование дерматоскопии, вспомогательного неинвазивного диагностического метода в клинической дерматологическом обследовании, может повысить точность диагностики пигментированных новообразований, включая меланому33.
В мета-анализе 27 исследований Kittler и соавторы34 показали 49 %-е повышение точности диагностики, 6 и 19 %-е специфичности и чувствительности соответственно. Более того, в рандомизированном исследовании для оценки процедур, предназначенных для диагностики пигментных новообразований при помощи дерматоскопа, Carli и соавторы35 отметили сокращение количества пациентов, направленных на биопсию (9 % против 15,6 %).
В последние десятилетия в дерматоскопии были описаны несколько диагностических алгоритмов распознавания меланомы, включая метод оценки паттерна, правило ABCD, 7-точечное правило, алгоритм CASH, метод Мензиса и другие33. При сравнении трех алгоритмов (анализ паттерна, правило ABCD и 7-точечное правило) Annensi и соавторы36 показали, что анализ паттерна обеспечивал наивысшую чувствительность, специфичность и точность диагностики тонких меланом. Хотя это не решает вопрос сложности диагностики, свойственные атипичным невусам, дерматоскопическая оценка и особенно мониторинг значительно улучшают контроль таких новообразований с неопределенным поведением37 (Рисунок 4).
Признаки, описанные в анализе паттерна как наиболее распространенные для диспластических невусов, следующие: атипичная пигментная сеть; участки нерегулярной пигментации и депигментации по краям; неоднородная пигментация в центре, резкий обрыв границ и коричневые глобулы различных форм и размеров с нерегулярным распределением38,39. Эти пигментные новообразования с очень атипичным или неспецифическим дерматоскопическим паттерном должны иссекаться для постановки точного патологического диагноза40,41.
Более того, у пациентов со множественными невусами, включая диспластические и AMS, у которых наблюдается множество изменяющихся новообразований, только лишь дерматоскопии не всегда достаточно для разделения доброкачественных новообразований и отдельных новых подозрительных невусов8,42. Таким образом, мониторинг невусов у пациентов из группы риска методом тотального картирования и цифровой дерматоскопии важен как для ранней диагностики злокачественных новообразований, так и для минимизации неоправданных биопсий доброкачественных новообразований43,44.
| Основной критерий (обязательный) | Второстепенный критерий (как минимум 2) |
| — Лентигинозная или равномерная меланоцитарная дисплазия — Очаговая меланоцитарная атипия | — «Shoulder phenomenon» — Соединение эпителиальных тканей — Субэпидермальный концентрический ламеллярный фиброз — Поверхностный периваскулярный лимфоцитарный воспалительный инфильтрат+ |
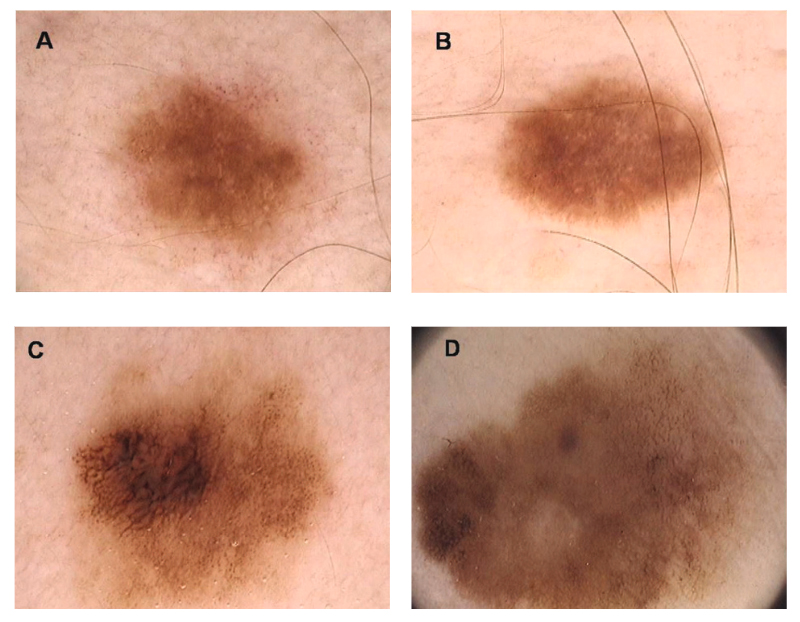
Рисунок 4. Цифровой дерматоскопический снимок (Х20) меланоцитарных новообразований, имеющих схожий дерматоскопический вид (A , B; C , D): A) сложный меланоцитарный невус; B) диспластический невус; C) диспластический пограничный невус с выраженной атипией; D) тонкая меланома
Тотальное картирование тела и цифровая дерматоскопия позволяют хранить макроскопические и дерматоскопические снимки для сравнения по прошествии времени. Обследование с использованием этого метода может проводиться при краткосрочном или долгосрочном наблюдении. Долгосрочное наблюдение проводится с интервалом 9–12 месяцев и больше подходит пациентам из группы риска, имеющим множественные невусы, включая страдающих AMS45.
При таком типе наблюдения изменения, которые показывают, что требуется иссечение новообразования, включают: рост, изменение формы, регрессию, изменение цвета и вида дерматоскопических структур, ассоциируемых с меланомой34.
В краткосрочном наблюдении повторная оценка новообразований должна проводиться в течение 3 месяцев с момента первого осмотра и показана для подозрительных меланоцитарных новообразований, у которых есть дерматоскопические признаки меланомы. Это включает клинически умеренные атипичные новообразования и менее атипичные, которые имеют историю изменений45. Новообразование должно быть удалено, если в нем присутствует любое морфологическое изменение, кроме изменения милий или общего вида пигментации46.
Рекомендации по контролю AMS-пациентов Важность раннего выявления и лечения меланомы определена и доказана разницей между кривой выживаемости пациентов на разных стадиях, созданной American Joint Committee on Cancer (AJCC), показывающей 5-летний рубеж выживаемости у около 95 % с I стадией и 15 % — у пациентов с IV стадией6,47. Поэтому стратегии наблюдения пациентов с высоким риском, таких как страдающих AMS, необходимы для оптимизации возможностей выявления меланомы на ранних стадиях3.
Поскольку большинство меланом являются вновь образованными и только 20–30 % вырастают из имеющихся невусов, атипичные меланоцитарные невусы считаются важным маркером риска26. Таким образом, профилактическое иссечение клинически диспластических невусов у субъектов с множественными невусами необоснованно и часто невозможно18. Такой подход может дать пациенту ложное чувство безопасности, поскольку риск меланомы остается даже при удалении меланоцитарных новообразований.
Периодическое дерматоскопическое обследование рекомендовано пациентам с диспластическими невусами или AMS раз в 3–12 месяцев в зависимости от позиции пациента в шкале риска, приведенной выше3. Таким образом, некоторые авторы предлагают, чтобы пациенты из группы 0 по Rigel, обследовались дерматологом ежегодно, а с высоким риском (группы I, II, III) — каждые 3–6 месяцев3. Согласно Tucker и соавторам32 риск меланомы у пациентов с AMS из семей с предрасположенностью к меланоме начинает возрастать примерно с 10-летнего возраста, поэтому рекомендуется начинать наблюдение в пубертатном периоде3.
Важно физическое обследование всего кожного покрова, поскольку большинство меланом возникают на закрытых участках, и предыдущие исследования показали, что меланома в 6 раз чаще выявлялась у пациентов, обследуемых полностью раздетыми3,48. Как упомянуто выше, дерматоскопия повышает точность диагностики меланоцитарной неоплазии, рекомендуется ее внедрение в протокол дерматологической консультации48,49,50,51. Однако даже с помощью дерматоскопа выявление новых и значимых изменений, имевшихся ранее невусов у лиц с множественными пигментными новообразованиями и AMS, может быть затруднено, что делает тотальное картирование тела и цифровую дерматоскопию важными инструментами в диагностическом процессе43,44.
В протоколе, которому следовала Dermoscopy Clinic of the Skin Oncology Department of Hospital AC Camargo, пациенты из группы риска обследовались повторно через 3 месяца после первого осмотра, затем через 6 месяцев с даты последнего осмотра и далее ежегодно.
В обзоре рисков у пациентов, которые прошли первое обследование в период с марта 2003 по ноябрь 2007 года, наблюдались в общей сложности 255 пациентов, 53 из которых страдали AMS. Из 14 307 наблюдавшихся новообразований 355 демонстрировали изменения во времени (2,5 %). При этом 10 из них были диагностированы как кожная меланома, все они имели толщину менее 1 мм, включая 5 меланом in situ.
Главными факторами риска, связанными со злокачественной трансформацией, была личная история меланомы (OR 11,3) и AMS (OR 5,1) (неопубликованные данные). Любое подозрительное новообразование и/или значительное изменение должно направляться на биопсию, предпочтительно иссечение с соблюдением хирургических границ (2 мм), обеспечивающее адекватные для гистопатологической оценки образцы3,8. Нехирургическая альтернатива, такая как поверхностное применение 5-фторурацила, системное применение изотретиноина, поверхностное использование третиноина с гидрокортизоном или без него, поверхностное нанесение имихимода и использование лазерной абляции неэффективны для безопасного удаления подозрительных ново- образований и не рекомендуются8,52.
Обучение пациентов с диспластическими невусами или AMS-методам самостоятельного обследования кожи относительно просто и недорого, и некоторые исследования предполагали повышенную степень выявления тонких меланом или большего процента выживаемости у пациентов, которые проводили самостоятельное обследование, по сравнению с теми, кто этого не делал18.
Slade и соавторы3 рекомендуют самостоятельное обследование кожи каждые 2-3 месяца. Принимая во внимание преобладание увеальной меланомы у пациентов с AMS, некоторые авторы рекомендуют стандартное ежегодное офтальмологическое обследование53,54. Ультрафиолет является неогенным фактором, влияющим на появление диспластических невусов3,55. Более того, UV-излучение действует как инициатор и промоутер процессов злокачественной трансформации меланоцитов3.
Было показано, что пациенты с наследственным AMS имели пониженную возможность восстановления повреждения ДНК, индуцированного воздействием ультрафиолета56,57. Поэтому пациентам следует избегать воздействия солнечных лучей и искусственного ультрафиолета (например, капсул для загара) и использовать средства защиты для предотвращения солнечного ожога3,18. Хотя нет документального подтверждения тому, что использование защитных средств предотвращает возникновение диспластических невусов или сокращает риск развития меланомы, было показано, что применение средств с защитным фактором как минимум 15 сокращает частоту появления актинического кератоза и развития меланоцитарных невусов3,18.
Пациентам следует рекомендовать не использовать средства защиты для более продолжительного пребывания на солнце, что на самом деле может увеличить риск меланомы3,19. Проспективные исследования показывают, что риск меланомы в семьях с пациентами, страдающими AMS, значителен32. Кроме того, пациенты, которых изначально рассматривали как имеющие спорадический AMS, на самом деле происходили из семей с AMS3. Поэтому рекомендуется обследовать родственников первой линии пациентов, страдающих AMS, дерматологом на предмет наличия диспластических невусов, AMS или меланомы.
Поскольку носители AMS и FAMMM показывают связь между меланомой и другими внутренними злокачественными состояниями (панкреатическая неоплазия, опухоли ЦНС, рак груди)3, в случае подозрения симптомов у таких пациентов рекомендована оценка специалистов. В настоящее время нет научной базы для генетического тестирования пациентов с AMS, кроме протоколов исследований18,58,59.
Заключение
AMS несомненно увеличивает риск развития меланомы, злокачественной опухоли, частота по- явления которой значительно увеличивается в последние десятилетия и для которой крайне важна ранняя диагностика4,59. Выявление пациентов с AMS — главным клиническим фактором риска, позволяет включать их в программы краткосрочного и долгосрочного наблюдения, направленные на раннее выявление подозрительных новообразований и, как следствие, сокращения смертности, связанной с прогрессирующей меланомой42. Кроме того, профилактические программы могут внести вклад в распространение знаний и изменение поведения, создающего риск заболеваемости, минимизируя внешние риски не только для пациентов, но и для их семей.
Список литературы
1. Newton JA, Bataille V, Griffiths K,
Squire JM, Sasieni P, Cuzick J, et al. How common is the atypical mole
syndrome phenotype in apparently sporadic melanoma? J Am Acad Dermatol.
1993;29: 989-96, doi: 10.1016/ 0190-9622(93)70279-3.
2.
Gandini S, Sera F, Cattaruzza MS, Pasquini P, Abeni D, Boyle P, et al.
Meta-analysis of risk factors for cutaneous melanoma: I. Common and
atypical naevi. Eur J Cancer. 2005;41:28-44.
3.
Slade J, Marghoob AA, Salopek TG, Rigel DS, Kopf AW, Bart RS. Atypical
mole syndrome: Risk factor for cutaneous malignant melanoma and
implications for management. J Am Acad Dermatol. 1995;32:479-94, doi:
10.1016/0190-9622(95)90073-X.
4. Miller AJ, Mihm MC Jr. Melanoma. N Engl J Med. 2006;355:51-65.
5. Thompson JF, Scolyer RA, Kefford RF. Cutaneous Melanoma. Lancet. 2005;365:687-701.
6.
Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et
al. Final Version of 2009 AJCC Melanoma Staging and Classification. J
Clin Oncol. 2009;27:6199-206, doi: 10.1200/JCO.2009.23. 4799.
7. Tsao H, Atkins MB, Sober AJ. Management of Cutaneous Melanoma. N Engl J Med. 2004;351:998-1012.
8.
Friedman RJ, Farber MJ, Warycha MA. The ‘‘dysplastic’’ nevus. Clin
Dermatol. 2009;27:103-15, doi: 10.1016/j.clindermatol.2008.09.008.
9. Nelson AA, Tsao H. Melanoma and genetics. Clin Dermatol. 2009; 27:46- 52, doi: 10.1016/j. clindermatol.2008.09.005.
10. Norris W. Case of Fungoid Disease. Edinburgh Medical and Surgical Journal. 1820;16:562-65.
11.
Clark WH Jr, Reimer RR, Greene M, Ainsworth AM, Mastrangelo MJ. Origin
of familial malignant melanomas from heritable melanocytic lesions. ‘The
B-K mole syndome’. Arch Dermatol. 1978;114:732-8, doi: 10.
1001/archderm.114.5.732.
12.
Roesch A, Burgdorf W, Stolz W, Landthaler M, Vogt T. Dermatoscopy of
‘‘dysplastic nevi’’ : A beacon in diagnostic darkness. Eur J Dermatol.
2006;16:479-93.
13. Elder DE. The dysplastic nevus. Pathology. 1985;17:291-7, doi: 10.3109/ 00313028509063770.
14.
Clark WH Jr, Elder DE, Guerry D 4th, Epstein MN, Greene MH, Van Horn M.
A study of tumor progression: the precursor lesions of superficial
spreading and nodular melanoma. Hum Pathol. 1984; 15:1147-65, doi:
10.1016/S0046-8177(84)80310-X.
15.
Rigel DS, Rivers JK, Friedman RJ, Kopf AW. Risk gradient for malignant
melanoma in individuals with dysplastic naevi. Lancet. 1988;1:352-3,
doi: 10.1016/S0140-6736(88)91139-7.
16.
Kraemer KH, Greene MH, Tarone R, Elder DE, Clark WH Jr, Guerry D 4th.
Dysplastic naevi and cutaneous melanoma risk. Lancet. 1983; 2: 1076-7,
doi: 10.1016/S0140-6736(83)91055-3.
17.
Carey WP, Thompson CJ, Synnestvedt M, Guerry D 4th, Halpern A, Schultz
D, et al. Dysplastic Nevi as a Melanoma Risk Factor in Patients with
Familial Melanona. Cancer. 1994; 74: 3118-25, doi: 10.1002/1097-
0142(19941215)74:12,3118::AID-CNCR2820741210.3.0.CO;2-7.
18. Naeyaert JM, Brochez L. Dysplastic Nevi. N Engl J Med. 2003; 349:2233- 40.
19.
Berwick M, Erdel E, Hay Jennifer. Melanoma Epidemiology and Public
Health. Dermatol Clin. 2009;27:205-14, doi: 10.1016/j.det.2008.12.002.
20.
de Snoo FA, Hottenga JJ, Gillanders EM, Sandkuijl LA, Jones MP, Bergman
W, et al. Genome-wide linkage scan for atypical nevi in p16-Leiden
melanoma families. Eur J Hum Genet. 2008;16:1135-4.
21.
Kraemer KH, Greene MH. Dysplastic nevus syndrome: familial and sporadic
precursor of cutaneous melanoma. Dermatol Clin. 1985;3:225- 37, doi:
10.1016/0738-081X(85)90096-3.
22.
Celebi JT, Ward KM, Wanner M, Polsky D, Kopf AW. Evaluation of germline
CDKN2A, ARF, CDK4, PTEN, and BRAF alterations in atypical mole
syndrome. Clin Exp Dermatol. 2005;30:68-70, doi: 10.1111/j.1365-
2230.2004.01656.x.
23. Landman G. Atypical (dysplastic) cell nevus: histopathology and historical aspects. Acta oncol. Bras. 2003;23:514-20.
24.
Goldstein AM, Martinez M, Tucker MA, Demenais F. Gene-covariate
interaction between dysplastic nevi and the CDKN2A gene in American
melanoma-prone families. Cancer Epidemiol Biomarkers Prev.
2000;9:889-94.
25. Chaudru V,
Laud K, Avril MF et al. Melanocortin-1 receptor (MC1R) gene variants and
dysplastic nevi modify penetrance of CDKN2A mutations in French
melanoma-prone pedigrees. Cancer Epidemiol Biomarkers Prev.
2005;14:2384-90, doi: 10.1158/1055-9965.EPI-04-0777.
26.
Bevona C, Goggins W, Quinn T, Fullerton J, Tsao H. Cutaneous melanomas
associated with nevi. Arch Dermatol. 2003;139:1620-4, doi:
10.1001/archderm.139.12.1620.
27.
Halpern AC, Guerry D 4th, Elder DE, Trock B, Synnestvedt M, Humphreys
T, . Natural history of dysplastic nevi. J Am Acad Dermatol.
1993;29:51-7, doi: 10.1016/0190-9622(93)70151-I.
28.
Kopf AW, Friedman RJ, Rigel DS. Atypical mole syndrome. J Am Acad
Dermatol. 1990;22:117-8, doi: 10.1016/S0190-9622(08)80006-0.
29. NIH Consensus conference. Diagnosis and treatment of early melanoma. JAMA. 1992;268:1314-9, doi: 10.1001/jama.268.10.1314.
30.
Rigel DS, Rivers JK, Kopf AW, Friedman RJ, Vinokur AF, Heilman ER, et
al. Dysplastic nevi: markers for increased risk for melanoma. Cancer.
1989;63:386-9, doi: 10.1002/1097-0142(19890115)63:2,386::AIDCN
CR2820630231.3.0. CO;2-6.
31.
Lynch HT, Frichot BC III, Lynch JF. Familial atypical multiple
molemelanoma syndrome. J Med Genet. 1978;.15:..352-6, doi:
10.1136/jmg.15.5.352.
32.
Tucker MA, Fraser MC, Goldstein AM, Elder DE, Guerry D 4th, Organic SM,
et al. The risk of melanoma and other cancers in melanoma-prone
families. J Invest Dermatol. 1993; 100: 350-5, doi: 10.1038/jid.1993.62.
33. Terushkin V, Halpern AC.
Melanoma Early Detection. Hematol Oncol Clin North Am. 2009;23:481-500,
doi: 10.1016/j.hoc.2009.03.001.
34.
Kittler H, Pehamberger H, Wolff K, Binder M. Follow-up of melanocytic
skin lesions with digital epiluminescence microscopy: patterns of
modifications observed in early melanoma, atypical nevi, and common
nevi. J Am Acad Dermatol. 2000;43:467-76, doi: 10.1067/mjd.2000.107504.
35.
Carli P, de Giorgi V, Chiarugi A et al. Addition of dermoscopy to
conventional naked-eye examination in melanoma screening: a randomized
study. J Am Acad Dermatol. 2004;50:683-9, doi: 10.1016/j.jaad.
2003.09.009.
36. Annessi G,
Bono R, Sampogna F, Faraggiana T, Abeni D. Sensitivity, specificity, and
diagnostic accuracy of three dermoscopic algorithmic methods in the
diagnosis ofdoubtful melanocytic lesions: the importance of light brown
structureless areas in differentiating atypical melanocytic nevi from
thim melanomas. J Am Acad Dermatol. 2007;56:759-67, doi:
10.1016/j.jaad.2007.01.014.
37.
Malvehy J, Puig S, Braun R, Marghood A, Kopf A. Lesiones Melanocı
́ticas In: Malvehy J, Puig S, Braun R, Marghood A, Kopf A, eds. Manual
de Dermatoscopı ́a. Barcelona: BCN Art Directe S.L.; 2006. p45-54.
38.
Rezze GG, Soares de Sa ́ BC, Neves RI. Dermatoscopia: o me ́todo de ana
́lise de padro ̃ es. An Bras Dermatol. 2006;81:261-8, doi:
10.1590/S0365- 05962006000300009.
39.
Soares de Sa ́ BC, Rezze GG. Dermatoscopia dos Nevos Atı ́picos. In:
Rezze GG, Soares de Sa ́ BC, Neves RI, eds. Atlas de Dermatoscopia
Aplicada, 1st. ed. Sa ̃o Paulo, SP: Lemar-Martinari; 2009. p103-7.
40.
Nathansohn N, Orenstein A, Trau H, Liran A, Schachter J. Pigmented
lesions clinic for early detection of melanoma: preliminary results. Isr
Med Assoc J. 2007;9:708-12.
41.
Bowling J, Argenziano G, Azenha A, Bandic J, Bergman R, Blum A, et al.
Dermoscopy key points: recommendations from the international dermoscopy
society. Dermatology. 2007;214:3-5, doi: 10.1159/000096904.
42.
Haenssle HA, Vente C, Bertsch HP, Rupprecht R, Abuzahra F, Junghans V,
et al. Results of a surveillance programme for patients at high risk of
malignant melanoma using digital and conventional dermoscopy. Eur J
Cancer Prev. 2004;13:133-8, doi: 10.1097/00008469-200404000- 00007.
43.
Lucas CR, Sanders LL, Murray JC, Myers SA, Hall RP, Grichnik JM. Early
melanoma detection:nonuniform dermoscopic features ad growth. J Am Acad
Dermatol. 2003;48:663-71, doi: 10.1067/mjd.2003.283.
44.
Banky JP, Kelly JW, English DR, Yetman JM, Dowling JP. Incidence of new
and changed nevi and melanomas detected using baseline images and
dermoscopy in patients with high risk for melanoma. Arch Dermatol.
2005;141:998-1006, doi: 10.1001/archderm.141.8.998.
45.
Menzies SW. Cutaneous melanoma: making a clinical diagnosis, present
and future. Dermatol Ther. 2006;19:32-9, doi:
10.1111/j.1529-8019.2005.00054.x.
46.
Menzies SW, Gutenev A, Avramidis M, Batrac A, McCarthy WH. Shortterm
digital surface microscopic monitoring of atypical or changing
melanocytic lesions. Arch Dermatol. 2001;137:1583-9.
47.
Balch CM, Buzaid AC, Soong SJ, Atkins MB, Cascinelli N, Coit DG, et al.
Final Version of the American Joint Committee on Cancer StagingSystem
for Cutaneous Melanoma. J Clin Oncol. 2001;19:3635-48.
48.
Rigel DS, Friedman RJ, Kopf AW, Weltman R, Prioleau PG, Safai B, et
al.Importance of complete cutaneous examination for the detection of
malignant melanoma. J Am Acad Dermatol. 1986;14: 857-60, doi: 10.
1016/S0190-9622(86)70100-X.
49.
Pehamberger H, Steiner A, Wolff K. In vivo epiluminescence microscopy
of pigmented skin lesions: I. pattern analysis of pigmented skin
lesions. J Am Acad Dermatol. 1987;17:571-83, doi: 10.1016/S0190-
9622(87)70239-4.
50. Steiner A,
Pehamberger H, Wolff K. In vivo epiluminescence microscopy of pigmented
skin lesions: II. Diagnosis of small pigmented skin lesions and early
detection of malignant melanoma. J Am Acad Dermatol. 1987;17:584-91.
51.
D Aurea Machado EDB. Histo ́ rio e Fundamentos da Dermatoscopia.
In:Rezze GG, Soares de Sa ́ BC, Neves RI, eds. Atlas de Dermatoscopia
Aplicada, 1st. ed. Sa ̃o Paulo, SP: Lemar-Martinari; 2009. p17-21.
52.
Stratigos AJ, Dover JS, Arndt KA. Laser treatment of pigmented lesions —
2000: how far have we gone? Arch Dermatol. 2000;136: 915-21, doi: 10.
1001/archderm.136.7.915.
53. Rodriguez-Sains RS. Ocular findings in patients with dysplastic nevus syndrome. Ophthalmology. 1986;93:661-5.
54.
Vink J, Crijns MB, Mooy CM et al. Ocular melanoma in families with
dysplastic nevus syndrome. J Am Acad Dermatol. 1990;23: 858-62, doi:
10.1016/0190-9622(90)70304-Z.
55.
Elwood JM, Gallagher RP, Hill GB, Spinelli JJ, Pearson JC, Threlfall W.
Pigmentation and skin reaction to sun as risk factors for cutaneous
melanoma: Western Canada Melanoma Study. Br Med J. 1984;288:99-102, doi:
10.1136/bmj.288.6411.99.
56.
Noz KC, Bauwens M, van Buul PP, Vrolijk H, Schothorst AA, Pavel S, et
al. Comet assay demonstrates a higher ultraviolet B sensitivity to DNA
damage in dysplastic nevus cells than in common melanocytic nevus cells
and foreskin melanocytes. J Invest Dermatol. 1996;106:1198-202, doi:
10.1111/1523-1747.ep12347994.
57.
Perera MI, Um KI, Greene MH, Waters HL, Bredberg A, Kraemer KH.
Hereditary dysplastic nevus syndrome: lymphoid cell ultraviolet
hypermutability in association with increased melanoma susceptibility.
Cancer Res. 1986;46:1005-9.
58.
Niendorf KB, Tsao H. Cutaneous melanoma: Family screening and genetic
testing. Dermatol Ther. 2006; 19: 1-8, doi: 10.1111/j.1529-8019.
2005.00050.x.
59. Pho L,
Grossman D, Leachman AS. Melanoma genetics: a review of genetic factor
and clinical phenotypes in familial melanoma. Curr Opin Oncol.
2006;18:173-9, doi: 10.1097/01.cco.0000208791.22442.09.
Вам также могут быть интересны статьи
- Роль дерматоскопии и цифрового дерматоскопического контроля в диагностике меланомы
- Неинвазивные средства визуализации в диагностике и лечении рака кожи
- Почему косметологические процедуры вызывают дискомфорт? Мифы о безболезненных процедурах
- От монотерапии RF к комплексному воздействию на все слои кожи, включая SMAS
- Наиболее частые ошибки дерматоскопии меланоцитарных новообразований