Gabriel Salerni1,2, Teresita Terán3, Carlos Alonso1,2, Ramón Fernández-Bussy1
1 Hospital Provincial del Centenario de Rosario, Argentina, &
Faculty of Medicine, Universidad Nacional de Rosario, Argentina
2 Diagnóstico Médico Oroño, Rosario, Argentina
3 Faculty, Department of Veterinary Medicine, Universidad Nacional de Rosario, Argentina
КЛЮЧЕВЫЕ СЛОВА: меланома, дерматоскопия, синдром атипичного (диспластического) невуса, наблюдение, методы визуализации.
Ссылки
Salerni G, Terán T, Alonso C, Fernández-Bussy R. The role of dermoscopy and digital dermoscopy follow- up in the clinical diagnosis of melanoma: clinical and dermoscopic features of 99 consecutive primary melanomas. Dermatol Pract Concept. 2014;4(4):7. http://dx.doi.org/10.5826/dpc.0404a07
Получена
31 мая 2014 года
Принята к печати
13 июня 2014 года
Опубликована
31 октября 2014
Copyright
©2014 Salerni и соавтор.
Эта
статья находится в свободном доступе, распространяется в соответствии с
условиями ли- цензии, с указанием авторства Creative Commons
Attribution License, допускающей неограниченное использование,
распространение, воспроизведение в любом средстве массовой информации с
указанием автора и источника.
Конфликт интересов
Отсутствуют.
Авторы
не имеют конфликта интересов, о котором необходимо сообщать. Все лица,
отвечающие критерию авторства, указаны как авторы, все они подтверждают,
что внесли достаточный вклад в работу, чтобы нести публичную
ответственность за ее содержание, включая участие в концепции,
структуре, анализе, написании и изменении манускрипта.
Ответственный автор
Gabriel
Salerni, MD, PhD, Urquiza 3100. CP: S2002KDR, Rosario, Argentina. Tel.
+54 341 4398586. Email: gabrielsalerni@hotmail.com
Краткий обзор
Актуальность исследования
Раннее выявление меланомы является важным фактором в улучшении прогноза ее развития.
Цель
Cообщить о значимости дерматоскопии и цифровой дерматоскопии в клинической диагностике злокачественной меланомы (ММ).
Методы
Ретроспективный анализ 99 последовательных первичных злокачественных
меланом, выявленных в период с 2010 по 2013 г. (ММ) были разделены на 3
группы:
1) ММ стала причиной обращения за консультацией (ММС).
2) ММ была выявлена во время стандартного осмотра невусов (ММRC).
3) ММ была диагностирована в результате изменений, отмеченных при цифровом дерматоскопическом наблюдении (ММDFU).
Оценивались клинические, дерматоскопические и гистологические признаки. Результаты В общей сложности 99 ММ были диагностированы у 89 пациентов (55 % мужчин), возраст которых составлял в среднем 50,8 (18-93) лет. Из всех ММ 35 послужили причиной каталог косметологических аппаратов б/у пациента за консультацией (MMC), 52 были выявлены во время стандартного осмотра невусов (MMRC) и 12 были диагностированы благодаря изменениям, выявленным методом цифрового дерматоскопического наблюдения (MMDFU).
При клиническом исследовании было определено, что правилу ABCD соответствовали 74,2 % ММС и только 30,7 % MMRC и 8,3 % MMDFU. Согласно данным дерматоскопии, были верно классифицированы как злокачественные, большинство ММС, 44,2 % MMRC и лишь 16,7 % MMDFU. 22,9 % MMC, 50 % MMRC и 58,3 % MMDFU были меланомами in situ. Средняя уровень инвазии по Бреслоу был значительно меньше в группе MMDFU (0,52 мм), чем в группах MMRC и MMС (0,77 и 1,43 мм соответственно).
Выводы
Использование дерматоскопии и цифровой дерматоскопии способствует выявлению злокачественной меланомы на ранней стадии даже в отсутствие специфического критерия злокачественности. Раннее выявление является наиболее эффективным фактором в улучшении прогноза для пациентов с первичной злокачественной меланомой (ММ) [1].
Дерматоскопия показала повышение чувствительности в клинической диагностике меланомы с 60 до 90 % со специфичностью 95 % [2]. Однако меланома может быть клинически и дерматоскопически схожей с меланоцитарным невусом, что делает раннюю диагностику затруднительной [3], особенно на ранних стадиях ее развития.
Кроме того, совпадение клинических признаков может привести к тому, что злокачественная меланома будет пропущена, а также к чрезмерному количеству ненужных иссечений доброкачественных новообразований [4].
Дерматоскопическое документирование меланоцитарных новообразований для сравнения текущего и предшествующих снимков на предмет незначительных изменений во времени, так называемое цифровое наблюдение (DFU), показало свою эффективность в диагностике ранних меланом, которые могут не соответствовать критериям злокачественности в достаточной степени. Этот метод доказал эффективность в выявлении ранних злокачественных меланом без увеличения количества ненужных удалений [5-7].
Использование исходных фотографий, так называемого тотального фотографирования тела (TBP), может усилить выявление новых новообразований и визуальных изменений существующих, по- скольку дает сравнительные данные серии последовательных осмотров [8].
Для обследования пациентам с высоким риском был предложен так называемый двухступенчатый метод цифрового наблюдения [9], предполагающий совместное использование TBP и цифровой дерматоскопии, поскольку является потенциально более точным, чем два метода по отдельности, и позволяет не только определять злокачественную меланому по минимальным дерматоскопическим критериям путем сравнения дерматоскопических записей, но также определять меланому, появившуюся как новый невус, или возникшую из новообразования, которое ранее дерматоскопически не наблюдалось [10].
Включение пациентов с высоким риском меланомы в программу наблюдения позволяет выявлять ее на ранней стадии с хорошим прогнозом, даже в отсутствие клинических и дерматоскопических признаков меланомы [11]. Целью настоящего исследования была оценка клинических, дерматоскопических и гистологических признаков меланомы, выявленных с использованием дерматоскопии при стандартном обследовании кожных покровов, и с использованием цифрового дерматоскопического наблюдения путем сравнения с теми меланомами, которые привели пациента на консультацию.
Методы
Мы провели ретроспективный анализ клинических и дерматоскопических характеристик 99 мела- ном, последовательно выявленных в течение 4 лет периода в Dermatology Department of the Hospital Provincial del Centenario de Rosario, больнице третьего уровня и в отделении рака кожи частного диагностического центра. В настоящее исследование включали первичные новообразования с клиническими и дерматоскопическими снимками приемлемого для надлежащей оценки качества.
Пациенты, у которых подтверждался диагноз меланомы после иссечения или биопсии (инцизионной или эксцизионной), исключались из исследования, так же как и те, у кого наблюдались повторные случаи меланомы или кожные метастазы предыдущих меланом.
Все меланомы, диагностированные в период с января 2010 по декабрь 2013 г., соответствовавшие критерию включения в исследование, были отобраны из базы данных. ММ были разделены на три группы:
1) ММ стала причиной обращения за консультацией (ММС).
2) ММ была выявлена во время стандартного осмотра невусов (ММRC).
3)
ММ была выявлена в результате изменений, отмеченных при исследовании
методом цифровой дерматоскопического наблюдения (Цифровое наблюдение
меланомы, ММDFU).
Клинические данные, такие как возраст или пол пациентов, а также локализация и размер ново- образований были включены в презентацию PowerPoint (Microsoft Corp, Redmond, Washington) наряду с клиническими и дерматоскопическими снимками. Данные были представлены двум дерматологам с опытом работы в дерматоскопии (G.S. и C.A.), которые слепым методом давали клиническую и дерматоскопическую оценку MMC, MMRC или MMDFU, личности пациентов и гистологическим характеристикам новообразований.
Для клинической оценки новообразований использовалась аббревиатура ABCD, применяемая для ранней оценки меланомы [11]. Дерматоскопическая оценка проводилась с применением правила ABCD Штольца на основе 4 критериев: асимметрия A; резкие границы B, цвета С, различные дерматоскопические структуры D [13].
Общая дерматоскопическая шкала (TDS) рассчитывалась для каждого новообразования, затем они классифицировались как доброкачественные, подозрительные или злокачественные. Как правило, пациентам, которые обращались за обследованием невусов, проводили полный осмотр при помощи ручного дерматоскопа (DermLite DL100 and DermLite II Pro Hybrid; 3Gen LLC, Dana Point, California).
Новообразования с явными признаками меланомы или атипичности удаляли и отправляли на гистопатологическое исследование; для подозрительных, но не соответствующих критериям ме ланомы новообразований могли назначить краткосрочное наблюдение. Пациенты с высоким риском включались в программу наблюдения с использованием метода тотального фотографирования и цифровой дерматоскопии, двухступенчатого метода, описанному выше [9], с контрольными осмотрами один или два раза в год.
При таком методе использовалось цифровое дерматоскопическое устройство (FotoFinder dermoscope, FotoFinder Systems GmbH, Germany). Критерием включения в программу наблюдения были умеренные или выраженные атипичные невусы (AMS), присутствие врожденных невусов от средних до гигантских, AMS и меланома в прошлом, семейный анамнез меланомы, наличие генетических мутаций, ассоциируемых с риском меланомы, и синдромы, относящиеся к высокому риску.
Значительными, приводившими к удалению в течение периода дерматоскопического наблюдения, считались следующие изменения: симметричное увеличение, изменение формы, очаговые изменения структуры, участки регрессии, изменение цветов. Все вновь появившиеся новообразования, отмеченные во время наблюдения и имеющие атипичные дерматоскопические признаки, но не соответствовавшие критерию отнесения к меланоме, фиксировались и включались в программу наблюдения, или же иссекались в зависимости от степени риска в отношении конкретного пациента и мнения эксперта. От каждого пациента получали письменное согласие на все инвазивные процедуры.
Статистический анализ
Для сравнения качественных переменных использовался критерий Хи-квадрат, при необходимости в случае малого размера образцов 2х2 применялся критерий Фишера, а также t-test для сравнения средних показателей. Различия рассматривались статистически значимыми при P ≤ 0,05
Результаты
Из всех меланом, выявленных с января 2010 по декабрь 2013 г., 99 соответствовали критерию включения в исследование, 35 (35,3 %) были причиной обращения пациента за консультацией (MMC), 12 (12,2 %) выявлялись благодаря изменениям, обнаруженным во время цифрового дерматоскопического наблюдения (MMDFU).
Популяция
Популяция исследования включала 40 (45 %) женщин и 49 (55 %) мужчин, возраст которых в среднем составлял 50,8 лет (19–93 лет). Распределение по полу был равномерным во всех трех группах.
Клиническая оценка
Большинство злокачественных меланом, которые приводили пациентов на консультацию (MMC), были клинически асимметричными, имели неровные границы и множество цветов, а также диаметр более 6 мм (Таблица 1). Из всех MMRC около 60 % были асимметричны и имели множественные цвета, половина имели неровные границы, более 70 % — диаметр 6 мм и более. Четверть MMDFU были асимметричны, только 16,6 % имели неровные границы, около 40 % — множество цветов, и половина были более 6 мм. Правилу ABCD соответствовали почти 75 % MMC, треть MMRC и только 8 % MMDFU (Рисунок 1). Все различия были статистически значимыми.
Таблица 1. Клинические признаки по правилу ABCD
| Клинический признак | Меланома, выявленная на консультации MMC, количество 35 | Меланома, выявленная при обычном осмотре MMRC, количество 52 | Меланома, выявленная в ходе цифрового наблюдения MMDFU, количество 12 | Значение P* |
| Асимметрия | 82,8% | 61,5% | 25% | <0,05 |
| Неровные границы | 80% | 50% | 16,6% | |
| Множество цветов | 85,7% | 57,6% | 41,6% | |
| Диаметр > 6 мм | 97,1% | 71,1% | 50% | |
| A+B+C+D | 74,2% | 32,6% | 8,3% |
Дерматоскопическая оценка
Классификация по правилу ABCD приведена в Таблице 2. Из общего количества MMC 82,9 % были верно отнесены к злокачественным, 11,4 % — к подозрительным и 5,7 % — к доброкачественным. В группе MMRC 44,2 % были корректно отнесены к злокачественным, 46,2 % — к подозрительным и 9,6 % — к доброкачественным. В группе MMDFU только 33,3 % были корректно классифицированы как злокачественные, 16,7 % как подозрительные и 50 % – как доброкачественные.
Большинство MMC (N=25, 71,4 %) имели многокомпонентный паттерн, согласно анализу паттерна, затем шел сетчатый узор (в 7 (15 %) случаях), 2 новообразования имели звездчатый и одно неопределенный паттерн. В группе MMRC более половины имели сетчатый паттерн (n=28), только 19 (36,5 %) мультикомпонентный. В этой группе глобулярный и неопределенный паттерн наблюдались в 2 и 3 случаях соответственно.
Среди меланом, выявленных в связи с изменениями в период наблюдения (MMDFU), почти 60% (n=7) имели сетчатый паттерн и 25 % (т=3) мультикомпонентный, 16,6 (n=2) имели глобулярный паттерн (Рисунок 2). Наиболее частым морфологическим изменением было асимметричное увеличение в 6 из 12 MMDFU случаев, очаговые изменения структуры в 3 из 12 и участки регрессии в 1 из 12 новообразований.
Одна злокачественная меланома была иссечена из-за симметричного увеличения и отсутствия других значимых изменений (Рисунок 3). Одна злокачественная меланома ММ была удалена, поскольку была отмечена как вновь появившееся новообразование при сравнительном анализе последовательных фотографий.
Гистологическая оценка
Процент меланом in situ в группах был таким: 22,9 % в группе MMC, 50 % в группе MMRC и 58,3 % в группе MMDFU. Изъязвления имели 22,9 % MMC, только 3,8 % в MMRC и ни одна из группы MMDFU. У меланом с инвазией среднее значение глубины по уровню инвазии по Бреслоу было 1,43 мм в группе MMC, 0,77 мм в группе MMRC и 0,52 мм — в MMDFU. Все эти различия были статистически значимыми.
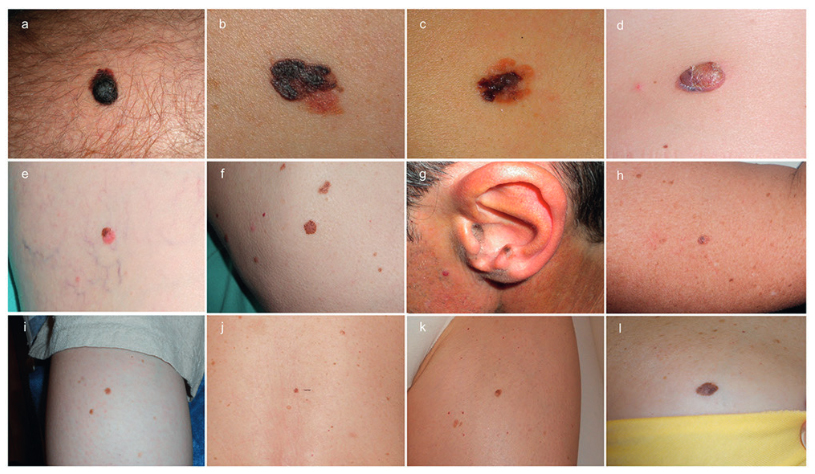
Рисунок 1. (A-D) Клинические снимки меланом, которые привели пациента на консультацию (MMC), (E-H) меланомы, выявленные во время стандартного осмотра (MMRC), и (I-L) меланомы, выявленные благодаря изменениям, отмеченным в ходе цифрового дерматоскопического наблюдения (MMDFU). (Copyright: ©2014 Salerni и соавторы)
Таблица 2. Дерматоскопические признаки
| Клинический признак | Меланома, выявленная на консультации MMC, количество 35 | Меланома, выявленная при обычном осмотре MMRC, количество 52 | Меланома, выявленная в ходе цифрового наблюдения MMDFU, количество 12 | Значение P* |
| Дерматоскопический паттерн | <0,05 | |||
| Ретикулярный атипичный | 15% | 53,8% | 58,3% | |
| Глобулярный атипичный | — | 3,8% | 16,7% | |
| Звездчатый | 5,7% | — | ||
| Неопределенный | 2,8% | 5,7% | ||
| Мультикомпонентный | 71,4% | 36,5% | 25% | |
| TDS | 6,2 | 5 | 4,77 | |
| Классификация по дерматоскопической шкале TDS | <0,05 | |||
| Доброкачественная | 5,7% | 9,6% | 50% | |
| Подозрительная | 11,4% | 46,2% | 16,7% | |
| Злокачественная | 82,9% | 44,2% | 33,3% |
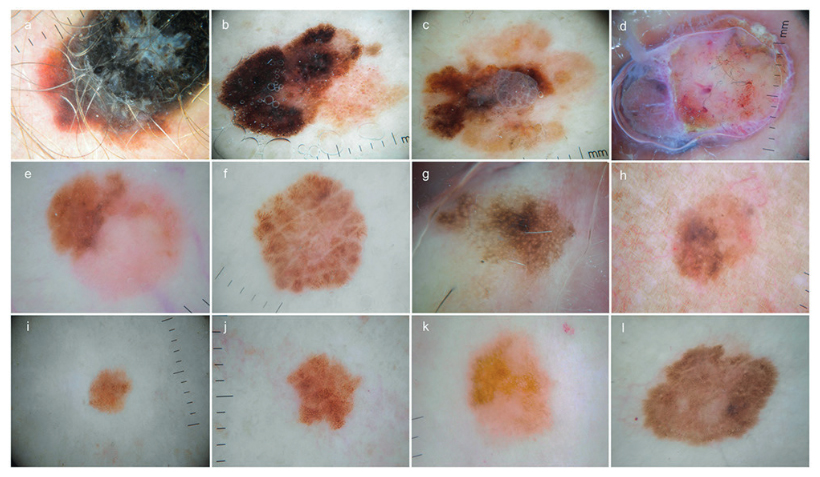
Рисунок 2. Дерматоскопические снимки. MMC (A-D): (A) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 2,5 мм, уровень инвазии по Кларку IV; (B) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,49 мм, по Кларку III; (C) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 1,7 мм, по Кларку IV; (D) Узловая меланома, уровень инвазии по Бреслоу 3,7 мм, по Кларку V. MMRC (E-H): (E) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,75 мм, по Кларку III; (F) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,35 мм, по Кларку II; (G) Меланома in situ; (H) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,7 мм, по Кларку III. MMDFU (I-L): (I) Меланома in situ; (J) Меланома in situ; (K) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,7 мм, по Кларку III; (L) поверхностно распространяющаяся меланома, уровень инвазии по Бреслоу 0,6 мм, по Кларку III. (Copyright: ©2014 Salerni и соавторы.)
Клиническая стадия в диагностике
Клиническая стадия меланомы классифицировалась согласно системе стадирования рака, разработанной Американским объединенным комитетом по раку (AJCC). В группе MMC 8 (22,8 %) имели стадию 0 во время диагностики и 14 (40 %) стадию IA, 5 (14,2 %) стадию IB, 6 (17,1 %) стадию II и 2 (5,7 %) стадию III, ни одна из меланом группы MMC не показывала стадию IV.
В группе MMRC 26 (50 %) показывали стадию 0, 21 (40,3 %) стадию IA, 3 (5,7 %) стадию IB и 2 (3,8 %) стадию II; ни у одной меланомы группы MMRC не было стадий III или IV. Среди MMDFU, 7 (58,3 %) показали стадию 0 и 5 (41,7 %) стадию IA, ни у одного не было стадий IB, II, III или IV. Различия между группами были статистически значимыми.
Биопсия сигнального лимфоузла требовалась 13 (37,1 %) из группы MMC, тогда как только 5 из 52 MMRC (9,4 %) и ни одному из MMDFU.
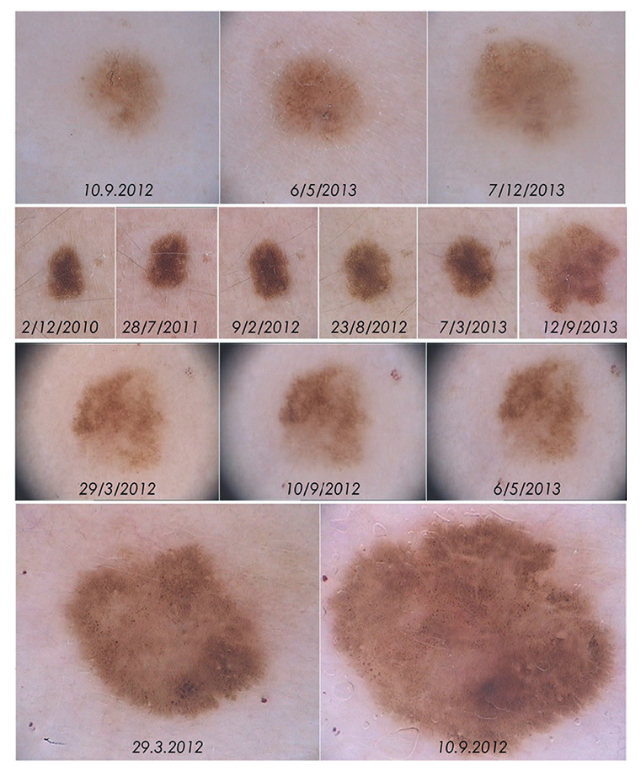
Рисунок 3. Меланомы, выявленные во время цифрового дерматоскопического наблюдения (MMDFU) и изменения, которые привели к иссечению. Изменения соответствуют новообразованиям I (первый ряд), J (второй ряд), K (третий ряд) and L (четвертый ряд) на Рисунке 2. (Copyright: ©2014 Salerni и соавторы)
Обсуждение Ранее выявление является наиболее эффективным способом улучшения прогноза развития меланомы [1]. В последние десятилетия достижения во вторичной профилактике способствовали стабилизации показателей смертности от меланомы. Правило ABCD было разработано почти 30 лет назад, чтобы предоставить населению и специалистам первичной медицинской помощи запоминающиеся и полезные инструменты для раннего выявления меланомы [12].
Параметры асимметрии, неровные границы, цвет (множественные цвета) и диаметр более 6 мм широко используются в медицинских образовательных программах и в прессе, чтобы обозначить простые параметры оценки пигментных новообразований кожи, которые могут требовать более полного обследования специалистом. Тогда как А, В и С критерии приняты большинством, появление сообщений о значительной доле меланом диаметром менее 6 мм [15, 16], вызвало противоречивые мнения в отношении критерия D, его значимости в распознавании ранних новообразований.
В нашем исследовании большинство меланом, которые приводили пациентов на консультацию (MMC), удовлетворяли всем 4 ABCD-критериям с 97 % новообразований с диаметром более 6 мм. Свыше 70 % MMRC имели диаметр > 6 мм, одна треть из них соответствовала одновременно 4 ABCD-критериям. В группе MMDFU большинство меланом были симметричны и не имели неровных границ, только 40 % имели множественную окраску и лишь половина диаметр > 6 мм. Менее 10 % MMDFU соответствовали сразу 4 критериям ABCD.
В 2014 году аббревиатура ABCD была пересмотрена, добавление признака Е-evolution, показывающего прогрессирование, значительно увеличило способность клиницистов и населению в целом выявлять меланому на ранней стадии, отмечая ее естественную динамику.
Последний критерий наиболее важен для диагностики узловой меланомы, которая, как правило, изначально симметрична, имеет ровные границы и немного цветов [17]. Дерматоскопия продемонстрировала способность увеличить точность раннего выявления меланомы [18–20], и в настоящее время обучение и применение дерматоскопии рекомендуется врачам, обследующим пигментные новообразования кожи [21].
Большинство меланом, которые приводили пациентов на консультацию, были уже клинически подозрительными (3/4 соответствовали 4 ABCD-критериям) и более 80 % были корректно классифицированы как злокачественные, со значительной долей меланом, неверно классифицированных и доброкачественных или подозрительных (почти 10 % и 50 % соответственно).
Эти открытия поддерживают рекомендацию о том, что дерматоскопия должна применяться в отношении всех новообразований, а не только для обследования подозрительных с клинической точки зрения [22], поскольку меланомы, выявленные у этой группы, представляли собой новообразования, о которых пациент не знал на момент консультации, или которые не привлекали его внимание ранее.
В недавнем исследовании Salerni и соавторы [11] сопоставляли меланомы, выявленные в ходе программы наблюдения, с меланомами, диагностированными в специализированных клиниках, и обнаружили, что 36 % меланом, выявленных во время наблюдения пациентов с риском меланомы, ошибочно отнесены к доброкачественным по правилу ABCD со значительно более низким средним значением TDS, чем у сопоставляемых. Они пришли к выводу, что дерматоскопическое наблюдение пациентов, которые относятся к группе высокого риска, позволяет выявлять меланомы с низкой степенью подозрительности.
Было сообщено, что меланома может симулировать доброкачественный меланоцитарный невус даже при дерматоскопическом исследовании [3]. На основе того, что доброкачественное новообразование остается стабильным, тогда как меланома меняется со временем, цифровое наблюдение меланоцитарных новообразований было предложено в качестве стратегии распознавания меланом, которые могут вначале не иметь явных дерматоскопических признаков [23].
В нашем исследовании 11 из 12 MMDFU были выявлены только за счет изменений, отмеченных в ходе программы наблюдения. В этой группе одна треть меланом были корректно классифицированы как злокачественные по правилу ABCD со средним показателем TDS, составляющим 4,77 (значительно ниже, чем в группах MMC и MMRC) показывая, что цифровое наблюдение помогает в диагностике ранней меланомы, когда специфические структуры или критерии злокачественности могут еще не присутствовать.
Таким же образом за 10 лет наблюдения пациентов с высоким риском меланомы в специализированной клинике [10, 24] были выявлены 98 меланом, при этом менее половины были классифицированы как злокачественные, согласно дерматоскопическому алгоритму. Уровень инвазии первичной опухоли по Бреслоу является главным фактором в прогнозе развития меланомы.
Criscione и Weinstock [25] анализировали данные программы наблюдений Surveillance Epidemiology and End Result (SEER) Национального института рака (National Cancer Institute) и обнаружили, что основные изменения в течение последних десятилетий происходили в отношении меланомы in situ, количество которой выросло с 25 % в 1988 году до 38 % в 2006 году.
В нашем исследовании пропорция меланомы in situ различается в зависимости от наблюдаемой группы: оно составляло менее четверти меланом, которые привели пациента на консультацию, но возросло до 50 % и почти 60 % с использованием дерматоскопии и цифровой дерматоскопии соответственно; подчеркивая преимущества последних достижений в выявлении меланомы на ранних стадиях. В связи с этим недавно был проведен метаанализ оценки эффективности наблюдения за меланоцитарными новообразованиями кожи с помощью цифровой дерматоскопии при контроле лиц с высоким риском меланомы [26].
Анализ подтвердил, что цифровое дерматоскопическое наблюдение меланоцитарных новообразований кожи методом цифровой дерматоскопии продемонстрировало ранее выявление меланомы при низком уровне иссечений. С применением стратегии диагностики доля меланом in situ и тонких меланом была больше, чем ожидалось, в популяции в целом.
Почти 60 % меланом из числа выявленных благодаря мониторингу изменений, были меланомами in situ; они были тоньше среди инвазивных, чем MMC и MMRC; ни одна из них не была изъязвленной. Ни одной меланоме из группы MMDFU и менее 10 % меланом из группы MMRC не требовалась биопсия сигнального лимфоузла (SNLB), тогда как почти 40 % MMC имели показания к SNLB, 6 % пациентов в этой группе имели стадию III во время диагностики. В настоящем исследовании мы сообщаем о ценности дерматоскопического обследования и цифрового наблюдения в клинической диагностике серии последовательно возникающих меланом.
Наши открытия подтверждают прежние наблюдения о том, что клиническая аббревиатура ABCD может определять только прогрессирующую меланому, поскольку большинство меланом, которые привели пациента на консультацию, уже имели определенную степень инвазии. В этой связи усилия по распространению знаний и обучению могут не иметь значительного эффекта.
Рутинное использование дерматоскопии в повседневной практике позволяет выявлять меланомы с низким индексом подозрительности, о которых пациенты не знают. Что касается пациентов с высоким риском, использование цифрового наблюдения позволяет выявлять раннюю меланому, для которой ограничены не только клинические, но и дерматоскопические признаки злокачественности.
Список литературы
1. Kopf AW, Welkovich B, Frankel RE, et
al. Thickness of malignant melanoma: global analysis of related
factors. J Dermatol Surg Oncol. 1987;13:345-20.
2.
Argenziano G, Soyer HP, Chimenti S, et al. Dermoscopy of pigmented skin
lesions: results of a consensus meeting via the Internet. J AmAcad
Dermatol. 2003;48(5):679-93.
3.
Puig S, Argenziano G, Zalaudek I, et al. Melanomas that failed
dermoscopic detection: a combined clinicodermoscopic approach for not
missing melanoma. Dermatol Surg. 2007;33(10):1262-73.
4.
Lindelöf B, Hedblad MA. Accuracy in the clinical diagnosis and pattern
of malignant melanoma at a dermatological clinic. J Dermatol.
1994;21:461-4
5. Carli P, De
Giorgi V, Crocetti E et al. Improvement of malignant/benign ratio in
excised melanocytic lesions in the ‘dermoscopy era’: a retrospective
study 1997-2001. Br J Dermatol. 2004;150:687-92.
6.
Carli P, de Giorgi V, Chiarugi A et al. Addition of dermoscopy to
conventional naked-eye examination in melanoma screening: a randomized
study. J Am Acad Dermatol. 2004;50:683-9.
7.
Kittler H, Binder M. Follow-up of melanocytic skin lesions with digital
dermoscopy: risks and benefits. Arch Dermatol. 2002;138:1379.
8. Halpern AC. Total body skin imaging as an aid to melanoma detection. Semin Cutan Med Surg. 2003;22:2-8.
9.
Malvehy J, Puig S. Follow-up of melanocytic skin lesions with digital
total-body photography and digital dermoscopy: a two-step method. Clin
Dermatol. 2002;20:297-304.
10.
Salerni G, Carrera C, Lovatto L et al. Benefits of total body
photography and digital dermoscopy (“two-step method of digital
follow-up”) in the early diagnosis of melanoma in high-risk patients. J
Am Acad Dermatol. 2012;67(1):e17-27.
11.
Salerni G, Lovato L, Carrera C, et al. Melanomas detected in follow-up
program compared with melanomas referred to a melanoma unit. Arch
Dermatol. 2011;147(5):549-55.
12.
Friedman RJ, Rigel DS, Kopf AW. Early detection of malignant melanoma:
the role of physician examination and self-examination of the skin. CA
Cancer J Clin. 1985;35(3):130-51.
13. Stoltz W, Braun-Falco O, Bilek P, et al. A Color Atlas of Dermoscopy. Berlin, Germany: Blackwell Science, 1994.
14.
Balch CM, Buzaid AC, Soong SJ, et al. Final version of the American
Joint Committee on Cancer staging system for cutaneous melanoma. J Clin
Oncol. 2001;19(16):3635-48.
15.
Goldsmith SM, Solomon AR. A series of melanomas smaller than 4 mm and
implications for the ABCDE rule. J Eur Acad Dermatol Venereol.
2007;21(7):929-34.
16. Gonzalez
A, West AJ, Pitha JV et al. Small-diameter invasive melanomas: clinical
and pathologic characteristics. J Cutan Pathol. 1996;23(2):126-32.
17.
Abbasi NR, Shaw HM, Rigel DS, et al. Early diagnosis of cutaneous
melanoma: revisiting the ABCD criteria. JAMA. 2004;292(22):2771-6.
18.
Bafounta ML, Beauchet A, Aegerter P, et al. Is dermoscopy
(epiluminescence microscopy) useful for the diagnosis of melanoma?
Results of a meta-analysis using techniques adapted to the evaluation of
diagnostic tests. Arch Dermatol. 2001;137:1343-50.
19. Kittler H, Pehamberger H, Wolff K, et al. Diagnostic accuracy of dermoscopy. Lancet Oncol. 2002;3:159-65.
20.
Vestergaard ME, Macaskill P, Holt PE, et al. Dermoscopy compared with
naked eye examination for the diagnosis of primary melanoma: a
meta-analysis of studies performed in a clinical setting. Br J Dermatol.
2008;159:669-76.
21.
Australian Cancer Network (ACN). Clinical practice guidelines for the
management of melanoma in Australia and New Zealand (2008). Available
from: http://www.nhmrc.gov.au/_files_nhmrc/publications/
attachments/cp111.pdf. Accessed May 2014.
22.
Seidenari S, Longo C, Giusti F, et al. Clinical selection of
melanocytic lesions for dermoscopy decreases the identification of
suspicious lesions in comparison with dermoscopy without clinical
preselection. Br J Dermatol. 2006;154: 873–8.
23.
Stolz W, Schiffner R, Pillet L, et al. Improvement of monitoring of
melanocytic skin lesions with the use of a computerized acquisition and
surveillance unit with a skin surface microscopic television camera. J
Am Acad Dermatol. 1996;35:202–7.
24.
Salerni G, Carrera C, Lovatto L, et al. Characterization of 1152
lesions excised over ten years using total body photography and digital
dermatoscopy in the surveillance of patients at high-risk for melanoma. J
Am Acad Dermatol. 2012;67(5):836-45.
25. Criscione VD, Weinstock MA. Melanoma thickness trends in the United States, 1988–2006. J Invest Dermatol. 2010;130:793–7.
26.
Salerni G, Terán T, Puig S, et al. Meta-analysis of digital dermoscopy
follow-up of melanocytic skin lesions: a study on behalf of the
international dermoscopy society. J Eur Acad Dermatol Venereol. 2013;
27(7):805-14.
Вам также могут быть интересны статьи
- Неинвазивные средства визуализации в диагностике и лечении рака кожи
- Почему косметологические процедуры вызывают дискомфорт? Мифы о безболезненных процедурах
- От монотерапии RF к комплексному воздействию на все слои кожи, включая SMAS
- Наиболее частые ошибки дерматоскопии меланоцитарных новообразований
- Когда алгоритмы дают сбой: описание клинического случая очень маленькой иссеченной меланомы